Detalle Actividad
Enfermedad hemorrágica del conejo: implicaciones de la aparición de una nueva variante
ROSA CASAIS GOYOS. Área de Sanidad Animal. Centro de Biotecnología Animal. SERIDA - Gijon. Deva. rosacg@serida.org DALTON KP. Instituto Universitario de Biotecnología de Asturias. Universidad de Oviedo. ANA BALSEIRO MORALES. Área de Sanidad Animal. Centro de Biotecnología Animal. SERIDA - Gijón. Deva. abalseiro@serida.org PARRA, JF. Instituto Universitario de Bioquímica Molecular. Universidad de Oviedo JOSÉ MIGUEL PRIETO MARTÍN. Área de Sanidad Animal. Centro de Biotecnología Animal. SERIDA - Gijón. Deva. jmprieto@serida.org
1. La enfermedad hemorrágica del conejo “clásica”
La enfermedad hemorrágica del conejo (RHD, del inglés rabbit haemorrhagic disease) es una patología infecciosa grave del conejo europeo (Oryctolagus cuniculus), descrita por primera vez a nivel mundial en 1984 en la República Popular de China (Liu et al, 1984).
En la actualidad la RHD es endémica en la mayor parte de Europa, Asia, norte de África y Oceanía. En Australia y Nueva Zelanda el virus causal de la enfermedad se introdujo de forma deliberada como agente de control biológico de las poblaciones de conejos silvestres. En España los primeros focos fueron descritos en Asturias y León por Argüello y col. en 1988.
La importancia de la RHD radica fundamentalmente en la cuantía de las pérdidas económicas que produce en las granjas productoras de carne y piel (por ejemplo, en Alemania la epidemia produjo durante 1989 la pérdida de 130 millones de marcos y la destrucción de 300 toneladas de carne). Las pérdidas están causadas por la elevada mortalidad, y los gastos derivados de la eliminación de cadáveres, la implementación de medidas higiénicas (limpieza y desinfección de jaulas/naves/equipamiento), la inversión en medidas de control-prevención, y la mano de obra para llevar a cabo estas tareas. Asimismo, la enfermedad ocasionó una severa reducción de las poblaciones de conejos silvestres de gran trascendencia ecológica (Delibes-Mateos y col., 2008) ya que el conejo de monte, además de ser fuente de alimento de especies protegidas como el lince, el zorro y el águila, es junto con la perdiz la principal pieza de caza menor en Europa.
La RHD es una enfermedad viral altamente contagiosa que afecta a conejos adultos de más de 2 meses de edad y no produce una mortalidad significativa en los gazapos (< 2 meses), a los que infecta de forma subclínica (Prieto y col., 2000). La morbilidad y la mortalidad son elevadas, pudiendo alcanzar casi el 100% en conejos adultos. Los animales muestran un comportamiento normal, aunque en algunos se observan signos de abatimiento, salivación y asfixia. El periodo de incubación es muy corto, entre 1 y 3 días, transcurrido el cual los conejos mueren súbitamente. La muerte súbita es consecuencia de un fallo multiorgánico, derivado del edema y de la congestión pulmonar, la necrosis adrenocortical, los desórdenes circulatorios, renales y la necrosis hepática (Rosell y col., 2000). En la necropsia los animales afectados muestran hemorragias generalizadas en diferentes tejidos entre los que se incluyen los pulmones, la tráquea, el hígado, el bazo, el corazón y, ocasionalmente, los riñones.
El agente que causa la enfermedad, denominado virus de la enfermedad hemorrágica de los conejos (RHDV, del inglés “Rabbit Haemorrhagic Disease Virus”), es un miembro de la familia Caliciviridae y fue descrito por primera vez en 1990 (Parra y Prieto, 1990; Ohlinger y col., 1990). Este virus se trasmite por contacto directo, probablemente por vía oral, nasal o conjuntival, y a través de materiales contaminados.
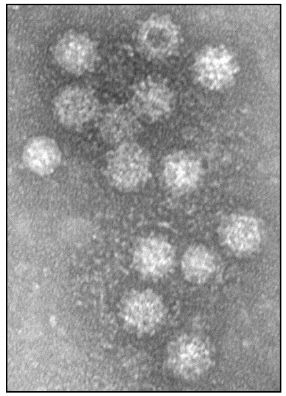
Figura 1. Micrografía conejos
El diagnóstico de confirmación de la enfermedad se basa en la identificación del virus y se realiza mediante distintas técnicas en el laboratorio: hemaglutinación (HA, las suspensiones de órganos de animales muertos a causa de la RHD, filtradas y concentradas por centrifugación, aglutinan eritrocitos humanos del grupo 0), enzimoinmunoensayo (ELISA), inmunohistoquímica utilizando anticuerpos anti-RHDV específicos, observación al microscopio electrónico del virus purificado (figura 1) y detección del ARN vírico extraído directamente a partir de los tejidos mediante RT-PCR específica. El hígado contiene el título más alto de virus y es en general el órgano de elección para la identificación del RHDV.
Prevención
Dadas las características de la enfermedad, especialmente su facilidad de transmisión, su rápido curso y elevada mortalidad, puede decirse que las medidas higiénicas y de bioseguridad así como el uso de vacunas son indispensables para evitar su diseminación y aminorar las pérdidas económicas que provoca.
Para la lucha contra la enfermedad se utilizan vacunas tisulares obtenidas a partir de suspensiones de órganos de conejos muertos, preferentemente el hígado, infectados experimentalmente con RHDV, clarificadas y adyuvantadas (Argüello Villares, 1991). Los animales vacunados producen una inmunidad protectora frente a la infección rápida (en un plazo de 7-10 días) y duradera (más de 1 año). Para obviar lo inaceptable de este procedimiento y evitar los riesgos del manejo del virus infectivo se han desarrollado innumerables sistemas de producción del antígeno mayoritario de la cápsida viral en sistemas heterólogos tales como bacterias (Boga y col., 1994), baculovirus (Marín y col., 1995), levaduras (Boga y col., 1997), plantas (Castañón y col., 1999), adenovirus (Fernández y col., 2011) y mixoma virus (Bárcena y col., 2000), aunque sólo el desarrollado por Spibey y col. (2012) ha llegado al mercado.
La experiencia en España con el RHDV clásico indica que la vacunación es la única arma útil en el control de la enfermedad evitando que aparezcan más brotes epidémicos. En España la eficacia de las vacunas y la poca variabilidad antigénica de los virus circulantes habían permitido que la enfermedad tuviese un impacto reducido y controlado hasta 2011. En la actualidad, la RHD es una enfermedad de declaración obligatoria (Real Decreto 617/2007 y la Ley 8/2003 de sanidad animal).
2. Estado actual: Aparición de una “nueva variante” de la enfermedad hemorrágica del conejo
En noviembre de 2011 se detectaron brotes atípicos de RHD en granjas comerciales españolas de conejos de Navarra (Dalton y col, 2012), Aragón y Cataluña. Casos similares se detectaron también en Francia (Le Gall y col., 2011), Italia (Le Gall-Reculé y col., 2013) y Portugal (Abrantes y col., 2013).
El aumento progresivo de los casos atípicos de RHD llevó a la investigación del virus responsable de esta nueva patología. Los primeros análisis de los casos detectados en noviembre de 2011 en Navarra permitieron detectar en tejidos de gazapo la presencia de un virus (RHDV-N11), genéticamente más cercano a los virus apatogénicos de conejo (RCVs) que a los RHDV “clásicos” (Dalton y col., 2012). Antigénicamente la “nueva variante” del RHDV también mostraba diferencias importantes con respecto al RHDV “clásico”. Por ejemplo, los extractos de hígado de animales con RHD variante no aglutinan glóbulos rojos del grupo 0 que si son aglutinados por el RHDV clásico (Figura 2) (Dalton y col., 2012). Se concluyó así que se trataba de una “nueva variante” del virus RHDV genética y antigénicamente distinta de los RHDV “clásicos”.

Figura 2. Nueva variante RHDV
Patología
Las diferencias fundamentales a nivel patológico entre la enfermedad causada por el RHDV clásico y la producida por la “nueva variante” del RHDV son las siguientes:
• La susceptibilidad de animales jóvenes a la “nueva variante” del virus El RHDV-N11, a diferencia del RHDV clásico, causa enfermedad en gazapos (el virus se ha detectado en conejos jóvenes de entre 11 y 35 días). Las razones que justifican esta diferencia de susceptibilidad se desconocen pero podría ser debida a cambios en receptores tejido-específicos o a cambios en la respuesta inmune que ocurren cuando el gazapo se desarrolla a adulto.
• La susceptibilidad a la “nueva variante” de RHDV de animales adultos vacunados, que indica que las vacunas actuales no protegen frente a RHDV-N11 (Dalton y col., 2012).
• La tasa de mortalidad. El RHDV clásico se caracteriza por afectar a conejos mayores de 2 meses de edad, con una tasa de mortalidad cercana al 90%. Sin embargo, la tasa de mortalidad asociada a la “nueva variante” varía entre el 10% en adultos hasta, aproximadamente, el 50% en gazapos menores de 35 días. La baja tasa de mortalidad en adultos provocada por la “nueva variante” podría conllevar un mayor número de animales supervivientes portadores de virus, que constituirían una fuente diferente de contagio del virus.
• El tropismo tisular y las vías de diseminación. Estudios preliminares han mostrado la presencia de RHDV-N11 en el intestino (figura 3), lo cual abre la posibilidad de la eliminación del virus a través de las heces, una fuente alternativa de contaminación con respecto al RHDV clásico que se transmite en secreciones corporales de conejo a conejo y a través de utensilios veterinarios y materiales de trabajo.
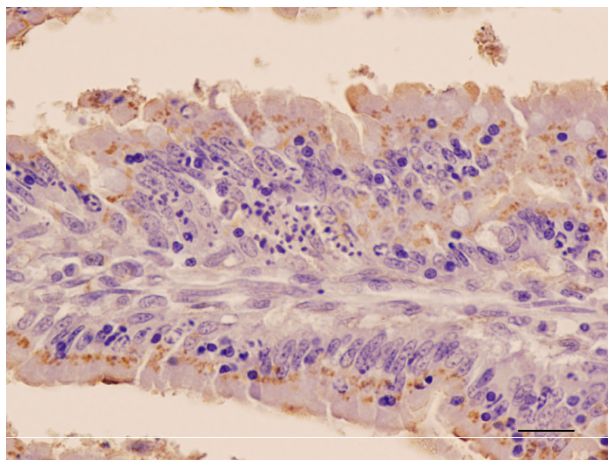
Figura 3. Inmuhistoquimica conejos
Epidemiología, diagnóstico y profilaxis
En los últimos dos años la “nueva variante” del virus se ha extendido por toda la Península Ibérica alcanzando niveles casi endémicos (Dalton y col., 2014) (figura 4), observándose una alta densidad de brotes sobre todo en aquellas áreas con una densidad más elevada de granjas cunícolas. En Asturias hasta el momento no se han detectado casos quizás debido al bajo número de granjas que existen hoy en día en la región. A pesar de ello la situación actual con nuevos brotes de la enfermedad en regiones limítrofes requiere la aplicación de medidas de control efectivas. La alarma causada por la enfermedad ha impulsado al Ministerio de Agricultura, Alimentación y Medio Ambiente (MAGRAMA) a iniciar un plan de vigilancia activa y pasiva de la misma. Datos oficiales publicados por el MAGRAMA (vigilancia activa) indican que el 17,9% de las granjas visitadas resultaron positivas a la “nueva variante” utilizando técnicas serológicas y moleculares. Asimismo, el impacto de estos brotes en la cunicultura española hizo que el INIA incluyese las nuevas cepas de la enfermedad hemorrágica vírica en el listado de enfermedades emergentes de especial interés para la mejora sostenible de los sistemas de producción ganadera.
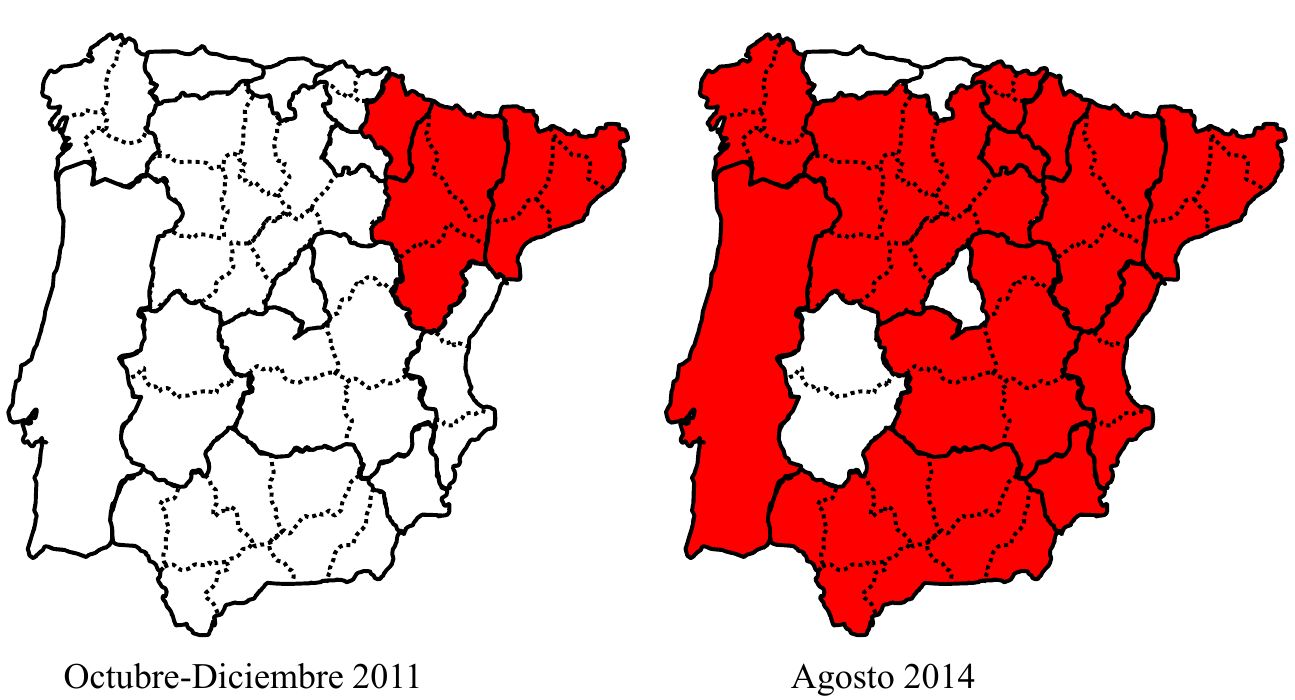
Figura 4. Mapa Península Ibérica RHDV.
En la actualidad el diagnóstico de la “nueva variante” se realiza en varias fases. En primer lugar se utiliza un ELISA comercial que detecta todas las cepas de RHDV. A continuación las muestras positivas al ELISA se someten a una RT-PCR específica de la “nueva variante” (Dalton y col., 2014). Y por último, las muestras negativas a esta RT-PCR se les aplica una RT-PCR general para RHDVs. Las secuencias identificadas por Dalton y col. (2014) han sido útiles para el desarrollo de las nuevas técnicas de detección del virus desarrolladas por laboratorios de diagnóstico.
Los estudios realizados hasta el momento indican que las vacunas tisulares desarrolladas frente al virus “clásico” no funcionan frente a la “nueva variante” y resaltan la importancia del desarrollo de nuevas vacunas y pautas de vacunación eficaces. En este sentido, en 2013 se autorizó, temporalmente y en regiones específicas, el uso de la vacuna Filavac VHD variant (Filavie, Francia). Más recientemente han salido al mercado nuevas vacunas inactivadas de empresas Españolas.
Actuaciones futuras
A pesar de su reciente aparición el virus RHDV-N11 ya es responsable de elevadas pérdidas económicas en cunicultura debidas a: 1) La rapidez de la expansión de la enfermedad, a pesar de la disponibilidad de vacunas frente al RHDV “clásico”, indicando que las vacunas actuales no son eficaces frente a la “nueva variante” del virus, 2) La susceptibilidad de animales jóvenes que involucra a parte de la población previamente no-susceptible al RHDV, lo que hace necesario vacunar un número más elevado de animales (hay que vacunar gazapos, antes no) , y 3) La aparición de brotes persistentes de la enfermedad en algunas granjas que hacen necesario el vacío sanitario para el control del virus, afectando a las exportaciones al extranjero. Todo ello supone un impacto económico-social importante en el sector.
Desde la identificación del RHDV clásico AST-89 como agente etiológico de la enfermedad en 1990 hasta el momento, el Área de Sanidad Animal del SERIDA ha colaborado con el Instituto Universitario de Biotecnología de Asturias, de la Universidad de Oviedo, realizando diversos estudios que han contribuido al mejor conocimiento y control del RHDV. Por ello, con el objeto de profundizar en el estudio del comportamiento de este virus y dar respuestas adecuadas para la correcta gestión de las granjas cunículas, desde el SERIDA y en colaboración con la Universidad de Oviedo se ha planteado el proyecto “Nueva variante del RHDV (RHDV-N11): Estudio de la patogenia y la respuesta inmune en conejos infectados experimentalmente o vacunados” que ha sido recientemente aprobado (E-RTA2013/00044), y cuyos objetivos concretos son los siguientes:
1. Estudio de la patogenia de la enfermedad hemorrágica vírica producida por la nueva variante del RHDV en conejos infectados experimentalmente de distintas edades.
2. Estudio de las vías de propagación del virus. Este conocimiento constituye un punto crítico para el control de la enfermedad en las granjas cunículas.
3. Caracterización de la respuesta inmune en conejos jóvenes y adultos infectados, vacunados con RHDV clásica o vacunados con la nueva variante de RHDV.
4. Verificación, en conejas reproductoras vacunadas, de la trasmisión de inmunoglobulinas a la leche y a gazapos recién nacidos. ¿Protege la vacunación de las madres a los gazapos?
Los objetivos estudiados, pueden ser la clave para diseñar las estrategias y pautas de vacunación más apropiadas para cada rango de edad. Asimismo, la caracterización del tropismo tisular y el estudio de las vías de diseminación del virus nos permitirán identificar las fuentes potenciales de contaminación, factor de gran relevancia para implantar nuevos mecanismos de control eficaces en la gestión de las granjas cunículas.
Referencias bibliográficas
ABRANTES, J., LOPES,A.M., DALTON, K.P., MELO, P., CORREIA, J.J., RAMADA, M., ALVES, P.C., PARRA, F., Esteves, P.J.: New variant of rabbit hemorrhagic disease virus, Portugal, 2012-2013. Emerg Infect Dis. 2013 19:1900-1902.
ARGÜELLO, J.L., LLANOS, A., PÉREZ, L.I.: Enfermedad hemorrágica del conejo en España. Med Vet 1988, 5:645-650.
ARGUELLO VILLARES JL: Viral haemorrhagic disease of rabbits: vaccination and immune response. Rev Sci Tech 1991, 10:471-480.
BÁRCENA, J., PAGÈS-MANTÉ, A., MARCH, R., MORALES M., RAMÍREZ, M.A., SÁNCHEZ-VIZCAÍNO, J.M., TORRES, J.M.: Isolation of an attenuated myxoma virus field strain that can confer protection against myxomatosis on contacts of vaccinates. Arch Virol. 2000, 145(4):759-71.
BOGA, J. A., CASAIS, R., MARÍN, M.S., MARTIN-ALONSO, J. M., CÁRMENTES, R.S., PRIETO, M. y PARRA, F.: Molecular cloning, sequencing and expression in Escherichia coli of the capsid protein gene from rabbit haemorrhagic disease virus (Spanish isolates AST/89). J. Gen. virol. 1994, 75:2109-2413.
BOGA, J. A., MARTIN-ALONSO, J. M., CASAIS, R. AND PARRA, F: A single dosis immunization with rabbit hemorrhagic disease virus major capsid protein produced in Sacharomyces cerivisiae induces protection. J. Gen. Virol. 1997, 78(9):2315-2318.
CASTAÑON, S., MARIN, M. S., MARTIN-ALONSO, J. M., BOGA, J. A., CASAIS, R., HUMARA, J. M., ORDAS, R. J., AND PARRA, F. : Inmunization with potato plants expressing VP60 protein protects against rabbit hemorrhagic disease virus. J.Virol. 1999, 73(5):4452-4455.
DALTON, K.P., NICIEZA, I., BALSEIRO, A., MUGUERZA, M.A., ROSELL, J.M., CASAIS, R., ALVAREZ, A.L., PARRA, F.: Variant rabbit hemorrhagic disease virus in young rabbits, Spain. Emerg Infect Dis 2012, 18:2009.
DALTON, K.P., NICIEZA, I., PARRA, F.: Spread of new variant RHDV in domestics rabbits in Spain. Vet. Microbiol. 2014, 169(1-2):67-73.
DELIBES-MATEOS, M., FERRERAS, P., VILLAFUERTE, R.: Rabbit populations and game management: the situation after 15 years of rabbit haemorrhagic disease in central southern Spain. Biodivers Conserv 2008, 17:559-574.
FERNÁNDEZ, E., TOLEDO, J.R., CHIONG, M., PARRA, F., RODRÍGUEZ, E., MONTERO, C., MÉNDEZ, L., CAPUCCI, L., FARNÓS, O.: Single dose adenovirus vectored vaccine induces a potent and long-lasting immune response against rabbit hemorrhagic disease virus after parenteral or mucosal administration. Vet Immunol Immunopathol. 2011,15:142(3-4):179-88.
LE GALL-RECULÉ G, ZWINGELSTEIN F, BOUCHER S, LE NORMAND B, PLASSIART G, PORTEJOIE Y, DECORS A, BERTAGNOLI 137–138.S, GUÉRIN J-L, MARCHANDEAU S: Detection of a new variant of rabbit haemorrhagic disease virus in France. Vet Rec 2011, 168(5):137-138.
LE GALL-RECULÉ G, LAVAZZA A, MARCHANDEAU S, BERTAGNOLI S, ZWINGELSTEIN F, CAVADINI P, MARTINELLI N, LOMBARDI G, GUÉRIN JL, LEMAITRE E, DECORS A, BOUCHER S, LE NORMAND B, CAPUCCI L: Emergence of a new lagovirus related to Rabbit Haemorrhagic Disease Virus. Vet Res 2013, 44:81.
LIU, S.J., XUE, H.P., PU, B.Q. y QUIAN, N.H. A new viral disease in rabbits. Anim. Husb. Vet. Med. 1984, 16:253-254.
MARÍN MS, MARTÍN ALONSO JM, PÉREZ ORDOYO GARCÍA LI, BOGA JA, ARGÜELLO-VILLARES JL, CASAIS R, VENUGOPAL K, JIANG W, GOULD EA, PARRA F.: Immunogenic properties of rabbit haemorrhagic disease virus structural protein VP60 expressed by a recombinant baculovirus: an efficient vaccine. Virus Res. 1995,39(2-3):119-28.
OHLINGER VF, HAAS B, MEYERS G, WEILAND F, THIEL HJ.: Identification and Characterization of the virus causing rabbit hemorrhagic disease. J Virol. 1990, 64(7):3331-6.
PARRA, F., PRIETO, M.: Purification and characterization of a calicivirus as the causative agent of a lethal hemorrhagic disease in rabbits. J Virol. 1990, 64:4013-4015.
PRIETO JM, FERNANDEZ F, ALVAREZ V, ESPI A, GARCIA MARIN JF, ALVAREZ M, MARTIN ALONSO JM, PARRA F.: Immunohistochemical localisation of rabbit haemorrhagic disease virus VP-60 antigen in early infection of young and adult rabbits. Res Vet Sci. 2000, 68:181-187.
ROSELL, J.M., ARGUELLO, J.L., BADIOLA, J.I., CUERVO, L., VANDEKERCKHHOVE, D. (2000). Enfermedades víricas. En: Enfermedades del conejo. Vol. II Rosell, J.M. (ed). Ediciones Mundi-Prensa, Madrid. Pp 301-353.
SPIBEY N, MCCABE VJ, GREENWOOD NM, JACK SC, SUTTON D, VAN DER WAART L.: Novel bivalent vectored vaccine for control of myxomatosis and rabbit haemorrhagic disease.Vet Rec. 2012, 170(12):309.
