Publicaciones SERIDA
Análisis del semen bovino
Carlos Olegario Hidalgo Ordóñez. cohidalgo@serida.org
Carolina Tamargo Miguel. ctamargo@serida.org
Carmen Díez Monforte. mcdiez@serida.org
El conocimiento de la fertilidad o de la capacidad fecundante de cada toro es uno de los principales objetivos en la producción de semen bovino. Un requisito indispensable para el desarrollo de la inseminación artificial es que el semen utilizado mantenga su capacidad de fertilidad después de haber sido criopreservado.
Entre las biotecnologías aplicadas a la reproducción, la inseminación artificial (IA) ha demostrado ser la herramienta más exitosa para la mejora genética de los animales de importancia zootécnica, especialmente en la industria bovina. De una cuidadosa valoración de la fertilidad dependerá la utilización futura del material seminal y el grado de aprovechamiento de los eyaculados obtenidos a lo largo de su vida reproductiva, esto es, las dosis producidas por eyaculado, en función del número de espermatozoides viables y, en definitiva, su mayor o menor rentabilidad. Este es un punto de suma importancia, debido a que un pequeño número de toros seleccionados es utilizado para inseminar una extensa población de hembras, con lo que los fallos en la selección de estos sementales tendrían como consecuencia importantes pérdidas económicas. Así, el conocimiento de la fertilidad o de la capacidad fecundante de cada toro se convierte en uno de los principales objetivos en la producción de semen bovino. Un requisito indispensable para el desarrollo de esta biotecnología es que el semen utilizado mantenga su capacidad de fertilidad después de haber sido criopreservado.
Muchos investigadores en el área de la reproducción animal están tratando de diseñar el "análisis seminal ideal", que valore adecuadamente y prediga la fertilidad de una muestra seminal. El análisis de semen ideal sería aquél que de forma sencilla y eficaz permitiera predecir la capacidad fecundante de un eyaculado concreto. Las cualidades que deben tener los espermatozoides de un eyaculado fecundante son: motilidad progresiva, morfología normal, metabolismo energético activo, capacidad para desarrollar una motilidad hiperactivada, integridad estructural y funcionalidad de la membrana, integridad de las enzimas asociadas con la fecundación, capacidad de penetración y transferencia óptima del material genético.
Sin embargo, este análisis integral es muy difícil de desarrollar, debido a la enorme complejidad inherente a la función espermática.
Los estudios actuales sobre contrastación seminal persiguen como objetivo final identificar algún parámetro cinético, morfológico o bioquímico que indique el estado de la célula espermática en un momento dado y que, al mmismo tiempo, pueda ser correlacionado con la fertilidad y calidad del eyaculado. No hay que olvidar que el objetivo del examen cualitativo del semen es asegurar que la fertilidad subsiguiente de dicho semen sea óptima. Sin embargo, las técnicas de contrastación del semen, tanto por su utilización en investigación y, especialmente, en la rutina de producción, deben ser precisas, sencillas, rápidas y económicas.
Actualmente, el análisis seminal clásico ha mejorado mediante la introducción de nuevas técnicas analíticas procedentes de otros campos de la investigación científica. Así, el estudio de la motilidad espermática, la concentración espermática y las anomalías morfológicas que anteriormente se hacían de manera subjetiva, pueden realizarse hoy en día mediante el uso de métodos computerizados de análisis. La incorporación de estos métodos informáticos atenúa en gran parte el factor subjetivo del análisis seminal y garantiza una mejor correlación con la capacidad fecundante del espermatozoide.

Espectrofotómetro ACUCELL (IMV Technologies, Francia).
Las técnicas de contrastación del semen, tanto por su utilización en investigación y, especialmente, en la rutina de producción, deben ser precisas, sencillas, rápidas y económicas .
Tras todo lo dicho, cabe destacar que hasta el momento no se ha conseguido un método de evaluación seminal in vitro, que al utilizarlo solo o en combinación con otros sea capaz de predecir de forma segura la capacidad fecundante de una muestra de semen. Sin embargo, debido a que la valoración in vitro de la calidad seminal es muy importante en la valoración andrológica de los machos y es, además, el mejor indicador del grado de conservación del semen congelado descongelado, se han dedicado grandes esfuerzos al diseño de técnicas que midan la capacidad fecundante del semen fresco y congelado.
Los parámetros clásicamente usados para conocer la calidad seminal de un eyaculado son los que siguen:
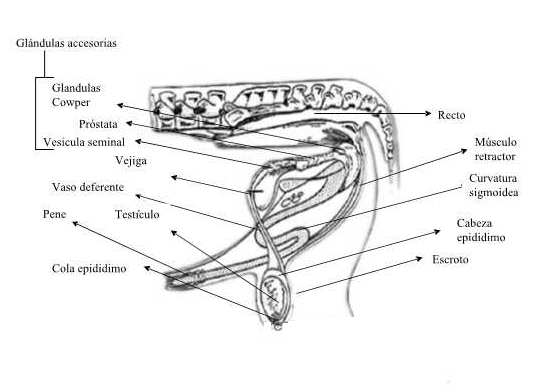
Esquema del aparato reproductor de un toro.
Concentración
Existe una alta correlación significativa entre el número de espermatozoides inseminados y la fertilidad del toro. La presencia de un mayor número de espermatozoides, siempre y cuando sus características sean normales, incrementa la posibilidad de fertilización. Este aspecto es crucial en el caso de los toros con baja concentración espermática, o en los casos en que se utiliza semen descongelado, que ha sido diluido y sometido a estrés durante el proceso de congelación descongelación, provocando un daño irreversible en un porcentaje elevado de espermatozoides. La fertilidad de un toro usado en IA, entre otras razones, dependerá básicamente del número de espermatozoides normales que se utilicen al inseminar.
Existe una variabilidad muy grande en la concentración de un eyaculado a otro, y de un toro a otro, siendo importante conocer el número de espermatozoides por eyaculado, ya que de este parámetro depende el número de hembras a inseminar. La concentración puede calcularse por varios métodos a partir de la muestra de semen. Entre estos métodos, destacan la espectrofotometría, la colorimetría, la citometría de flujo y el uso de cámara de recuento celular, como las de Bürker, Neubauer o Thoma. La espectrofotometría, técnica usada en nuestro laboratorio, es un método indirecto, que mide la luz monocromática absorbida por las partículas en suspensión o los espermatozoides. Esta densidad óptica de la muestra es comparada frente a una curva estándar patrón previamente validada, y permite, así, conocer el número de espermatozoides.
| CUALIDADES QUE DEBEN TENER LOS ESPERMATOZOIDES DE UN EYACULADO FECUNDANTE |
| -Motibilidad progresiva |
| -Morfología normal |
| -Metabolismo energético activo |
| -Capacidad para desarrollar una motibilidad hiperactivada |
| -Integridad estructural y funcionalidad de la membrana |
| -Integridad de las enzimas asociadas con la fecundación |
| -Capacidad de penetración |
| -Transferencia óptima del material genético |
Motilidad
La motilidad es uno de los parámetros más importantes de la analítica seminal. Hasta hace pocos años el estudio de la motilidad espermática se hacía exclusivamente mediante métodos semicuantitativos. Estos métodos evalúan el porcentaje de espermatozoides móviles, así como el tipo de movimiento que presentaba la media de una población espermática. Estas medidas ofrecen una descripción general de la motilidad espermática, pero la exactitud y precisión están limitadas por las condiciones del sistema de medida y por la destreza del observador. A pesar de ello, la valoración subjetiva de la motilidad hecha por personas experimentadas es de gran valor, debido a que la información se presenta de forma inmediata, al tiempo que es un método económico y de fácil ejecución.
Los primeros intentos de objetivizar el movimiento espermático se basaron en exposiciones fotográficas múltiples o video micrografías. Estos métodos son tediosos, largos y costosos, por lo que hoy en día no son de elección. Sin embargo, la aparición de los sistemas informatizados de digitalización de imágenes abrió un nuevo campo en el estudio de la motilidad de los espermatozoides. Estos sistemas, denominados genéricamente CASA (Computer Assisted Motility Analysis), han automatizado y simplificado el proceso. El análisis computerizado de la motilidad fue propuesto por primera vez hace 25 años y es usado actualmente en centros de investigación en andrología y centros de reproducción asistida. El CASA establece, de una manera efectiva, medidas cuantitativas del movimiento individual de los espermatozoides. Con este tipo de análisis se espera obtener medidas correctas de la motilidad espermática que proporcionen información precisa acerca del estado funcional del axonema y de las membranas espermáticas.
Los sistemas automáticos de medición de imágenes se basan en la captura sucesiva de espermatozoides en movimiento provenientes de un microscopio. Estas imágenes se digitalizan identificando las células espermáticas que contienen la primera imagen. Luego se procede al seguimiento de estas células en imágenes sucesivas y al establecimiento de trayectorias definitivas. Las trayectorias se procesan matemáticamente, obteniendo así resultados numéricos precisos. Los parámetros determinados para cada espermatozoide son la velocidad de movimiento sobre la base de varios descriptores, las trayectorias que realiza la cabeza del espermatozoide y la frecuencia de los cambios de dirección que efectúa.
Actualmente, también existen en el mercado varios tipos de CASA que capturan el movimiento espermático y lo analizan, tanto en tiempo real, como de manera diferida, aportando un gran volumen de información.

Componentes de un sistema CASA (Microptic/Barcelona, Versión 2002).
| DEFINICIONES | |
| Axonema | Eje interno del flagelo o proyección movil del espermatozoide y que permite su desplazamiento. |
| Acrosoma | Revestimiento interno de la cabeza del espermatozoide, cuya principal función es perforar la membrana del óvulo para penetrar en el mismo. |
| Ósmosis | Paso de una sustancia a través de una membrana semi impermeable que separa las soluciones de diferentes concentraciones. |
| Resistencia omótica | Capacidad del espermatozoide para captar agua cuando este se encuentra en un medio hipoosmótico. |
Viabilidad
La rotura de la membrana plasmática está claramente asociada con la pérdida de viabilidad celular, pero una membrana plasmática intacta no siempre indica que la célula sea viable. El procesado del semen, incluida su criopreservación, es "estresante" para el espermatozoide y afecta, primeramente, a sus membranas. Los daños que pueden producirse en éstas pueden ser modificaciones en su organización, permeabilidad y composición lipídica. Las membranas espermáticas que pueden verse afectadas por la criopreservación incluyen la membrana plasmática, la membrana externa del acrosoma y las membranas mitocondriales.
En cualquier caso, la criopreservación, cuyo propósito es garantizar la supervivencia del semen, causa daños irreversibles en la membrana plasmática, lo que conlleva la muerte de un gran número de espermatozoides o, en los supervivientes, cambios similares a los observados durante la capacitación espermática, que provoca un acortamiento de su período de vida útil.
La evaluación morfológica de la integridad de la membrana plasmática se realiza usando la óptica de contraste de fases, la óptica de contraste diferencial de interferencia o de Nomarski o las tinciones supravitales, como el verde rápido/eosina o la eosina/azul de anilina, el tripán azul/Giemsa o el amarillo de naftol/eritrosina. También ha sido valioso el examen a través de la microscopía electrónica o de barrido, para determinar aspectos de la integridad espermática. Actualmente, se están utilizando diversas tinciones fluorescentes, las cuales presentan una mayor precisión en el estudio de las características de la membrana plasmática. Así, se ha estado usando ampliamente el diacetato de carboxifluoresceína y el ioduro de propidio, visualizándose con esta técnica los espermatozoides viables de color verde, frente a los muertos que se observan de color rojo anaranjado (Fotografía 1).
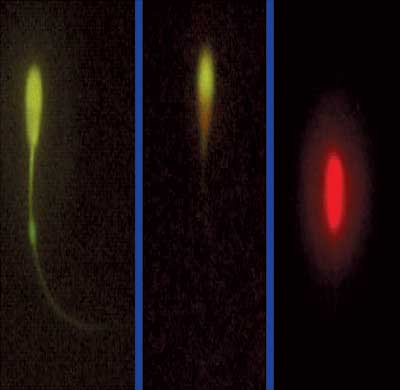
Fotografía 1.- Espermatozoides teñidos con ioduro de propidio y diacetato de carboxifluoresceína. El espermatozoide con membrana plasmática intacta se observa verde brillante, el moribundo comienza a estar rojo y el dañado es claramente rojo (1000x).
Estado del acrosoma
El acrosoma juega un papel fundamental en la fecundación y esta importancia hace que convenga realizar una valoración específica del mismo. En un espermatozoide que tenga el acrosoma en perfectas condiciones se pueden distinguir tres regiones claramente diferenciadas en la cabeza: la zona acrosomal, con un borde apical, la zona postacrosomal y el segmento ecuatorial entre ambas. Las muestras seminales con alta proporción de acrosomas alterados o ausentes suelen tener una fertilidad baja. Para determinar el estado del acrosoma se han usado desde hace mucho tiempo diferentes tinciones. Entre éstas tenemos la tinción de eosina/verde rápido, Giemsa y la de eosina/nigrosina, las dobles y triples tinciones, basadas en la combinación del azul tripán con otros colorantes y tinciones comerciales como el Spermac7. Recientemente, se han utilizado anticuerpos acrosomales específicos marcados con fluorescencia. En el caso de los espermatozoides bovinos, su tamaño permite poder valorarlos mediante un microscopio óptico de contraste de fases con un objetivo de gran aumento (Fotografía 2).
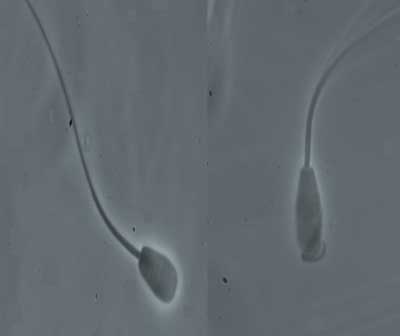
Fotografía 2.- Izquierda, espermatozoide con acrosoma intacto. Derecha, espermatozoide con acrosoma dañado (1000x).
Pruebas de funcionalidad espermática
La membrana espermática es una estructura dinámica que participa en el reconocimiento y transporte de moléculas. Estas funciones permiten que el espermatozoide adapte su metabolismo al medio circundante, proporcionando así un sistema molecular para el reconocimiento del ovocito. El análisis de la integridad de la membrana constituye una información importante en la evaluación de la fertilidad del macho. Además, esta integridad no sólo es fundamental para el metabolismo espermático, sino que también lo es para una adecuada capacitación y reacción acrosómica, y, por tanto, para la fertilidad del macho.
Un grupo de pruebas de funcionalidad espermática que han centrado gran interés por su simplicidad y su valor predictivo son las de resistencia osmótica. Estas pruebas se basan en la capacidad del espermatozoide para captar agua en un medio hiposmótico y en que la hinchazón osmótica está asociada con el enrollamiento de la cola del espermatozoide, que se desenrolla cuando la célula es devuelta a un medio isosmótico.
Dentro de las pruebas desarrolladas a partir de este fenómeno destaca el test de endósmosis que consiste en situar los espermatozoides en presencia de un medio de presión osmótica más baja que la fisiológica, lo que causa una entrada de agua en la célula en un intento de equilibrar la presión osmótica interna con la del medio externo. Para que esta respuesta se produzca, la membrana plasmática del espermatozoide debe estar íntegra y con los mecanismos de intercambio de fluidos funcionando correctamente. La entrada de agua provoca en estas células un hinchamiento y enrollamiento del flagelo (Fotografía 3). Las células con la membrana física o funcionalmente dañada no experimentan cambios en la forma del flagelo. Los valores obtenidos en esta prueba se correlacionan con otros parámetros de calidad seminal, como la motilidad, la viabilidad o la morfología.
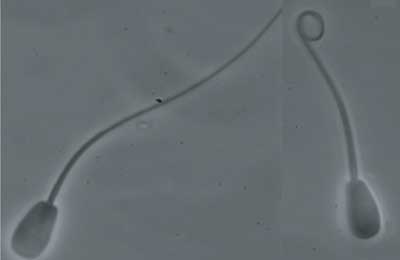
Fotografia 3.- Izquierda, espermatozoide negativo al test de endósmosis.Derecha, espermatozoide endómosis positivo (1000x)
Morfología
El análisis morfológico de los espermatozoides es uno de los principales componentes de la evaluación de las características de una muestra seminal. La valoración de la morfología del espermatozoide se basa en la relación directa que haya entre la proporción de espermatozoides anormales en el eyaculado, el tipo de defecto morfológico y su relación con la fertilidad in vivo de los toros.
Atendiendo a una clasificación estrictamente morfológica, las anomalías que puedan generarse se clasifican en anomalías en la cabeza, en el tracto intermedio y en la cola. Según el órgano donde pueden haberse generado diferenciamos las anomalías primarias y secundarias.
Esta evaluación de la morfología espermática puede ser utilizada para eliminar toros con pobre calidad seminal (Fotografía 4) y refleja la funcionalidad de los testículos, epidídimos y glándulas accesorias, por lo que siempre deben estar incluidas en las pruebas de evaluación espermática.
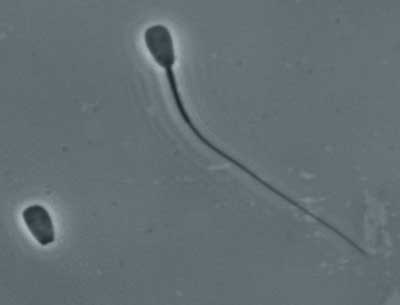
Fotografia 4.- Cabeza desprendida de un espermatozoide, junto a otro normal (400x)
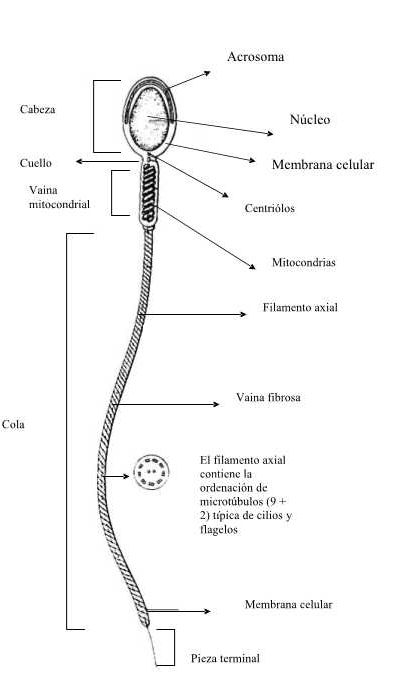
Esquema de un espermatozoide.
| Ficha Bibliográfica | |
|---|---|
| Título | Análisis del semen bovino |
| Autor/es | Carlos Olegario Hidalgo Ordóñez. cohidalgo@serida.org Carolina Tamargo Miguel. ctamargo@serida.org Carmen Díez Monforte. mcdiez@serida.org |
| Año Publicación | 2005 |
| Área | |
| Revista/Serie | Tecnología Agroalimentaria |
| Referencia | Época 2. Número 2 |
| Formato | |
| Depósito Legal | AS-2617/05 |
| ISSN | 1135-6030 |
| ISBN | |
| Ver/Descargar | |

