Ttransferencia de núcleo. © SERIDA
Producción de embriones
La producción de embriones bovinos in vitro se aplica, hoy en día, no sólo en investigación y como modelo para obtener embriones en otras especies, incluida la humana, sino también para obtener descendencia a partir de vacas de alto valor genético. También es útil para un último aprovechamiento de hembras sacrificadas por motivos sanitarios, accidentes o reposición. En la actualidad, la recuperación de ovocitos de hembras vivas por punción transvaginal guiada ecográficamente (Ovum Pick-Up; OPU) y su posterior maduración, fecundación y cultivo in vitro permite la producción de embriones que pueden ser criopreservados o bien transferidos a hembras receptoras (Kruip et al., 1994; Hasler et al., 1995).
Los avances más recientes permiten, además, producir
in vitro embriones de sexo conocido mediante la utilización de espermatozoides sexados procedentes de semen separado por
técnicas de análisis celular como la citometría de flujo, lo que posibilita una racionalización de la explotación de los rebaños.
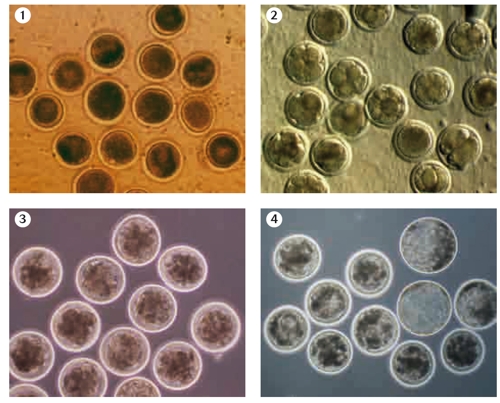
Figura 1. Zigotos bovinos producidos in vitro 1 día post-fecundación (post-FIV). © SERIDA
Figura 2. Embriones bovinos producidos in vitro en día 3 post-FIV. © SERIDA
Figura 3. Embriones bovinos producidos in vitro en día 6 post-FIV. © SERIDA
Figura 4. Embriones bovinos producidos in vitro en día 8 post-FIV. © SERIDA
Criopreservación
Un complemento indispensable para consolidar las técnicas de reproducción asistida es la posibilidad de criopreservar los embriones producidos.
La criopreservación es un proceso que consiste en mantener células, tejidos u organismos a muy bajas temperaturas con el fin de reducir o suspender sus funciones vitales y preservarlos vivos durante largos periodos de tiempo.
La criopreservación de embriones presenta numerosas ventajas, tanto desde el punto de vista biológico como del comercial. Entre ellas cabe destacar:
- permite reducir costes
- evita la dependencia de la actividad reproductiva cíclica y del estado fisiológico de los animales (hembras receptoras, por ejemplo),
- limita la deriva genética (cambios en las caracteristicas de una población debido a la variación en la frecuencia de los genes)
- elimina las patologías que normalmente se asocian al mantenimiento de animales vivos y
- hace posible la conservación de razas o especies en riesgo de extinción mediante la creación de bancos de embriones y/o gametos congelados.
En el ámbito del ganado vacuno, y en el marco de la Unión Europea, las estadísticas más recientes muestran que el 58% de los embriones transferidos son congelados (AETE, 2009).
El mayor obstáculo asociado a la difusión de la tecnología reproductiva in vitro es la falta de métodos eficaces para conservar a largo plazo los embriones producidos in vitro.
El campo de la
criobiología de los embriones bovinos empezó a explorarse durante la década de los 70, cuando se demostró que los embriones bovinos podían sobrevivir a la congelación (Wilmut y Rowson, 1973). Desde entonces, la investigación ha permitido simplificar los procedimientos de congelación y descongelación, con el fin de hacer posible el uso rutinario de estas técnicas, aumentando la viabilidad embrionaria tras la descongelación.
Sin embargo, los sistemas de producción in vitro dan lugar a embriones con características morfológicas y metabólicas diferentes a los que se obtienen in vivo (por superovulación y posterior lavado uterino de una hembra donante) (Lonergan et al., 2007; Wrenzycki et al., 2005). Los embriones producidos in vitro presentan citoplasmas (parte de la célula comprendida entre la membrana y el núcleo) más oscuros y con menor densidad, alteración en el número de células y su distribución, distinta expresión génica (mecanismo por el que la información codificada en un gen se traduce en estructuras y funciones de la célula) y mayor incidencia de anomalías cromosómicas. Estas diferencias se traducen en un menor rendimiento de los embriones producidos in vitro frente a los producidos in vivo (Leibo y Loskutoff, 1993; Leibo et al., 1996).
La eficacia de los sistemas de producción de embriones bovinos
in vitro oscila entre un 30 y un 40% de
blastocistos (fase del desarrollo embrionario temprano) con calidad suficiente para ser transferidos, sobre el total de los ovocitos puestos en cultivo (Gómez
et al., 2008). Aunque hay grandes evidencias de que las condiciones de cultivo post-fecundación son determinantes para la calidad de los embriones obtenidos (Lonergan
et al., 2001), hay que señalar que la eficiencia de la producción de embriones
in vitro está ligada no sólo al sistema de cultivo, sino a la calidad intrínseca de los ovocitos (Rizos
et al., 2008). Los índices de gestación tras la transferencia de embriones frescos producidos
in vitro oscilan en torno al 50%, cifras que se reducen cuando los embriones han sido criopreservados. En general, se asume que cuanto más se prolonga el tratamiento
in vitro, mayores son las diferencias entre los embriones producidos
in vivo y los obtenidos
in vitro (Rizos
et al., 2008).
En el ganado bovino,
la baja resistencia a la congelación de los embriones producidos
in vitro condiciona la difusión de esta tecnología. No obstante, la manipulación de los sistemas de cultivo puede permitir mejorar la calidad de los embriones, y aumentar la supervivencia
in vitro a la
vitrificación/desvitrificación. Así, la retirada del suero de los medios de cultivo y el incremento de las concentraciones de albúmina sérica bovina, combinadas con la aplicación de protocolos de vitrificación han demostrado incrementar la supervivencia de los embriones producidos
in vitro a la criopreservación (Gómez
et al., 2008).
Estrategias para la conservación de embriones
Hoy en día, se dispone de tres técnicas para la conservación de embriones: la congelación lenta (o clásica), la vitrificación tradicional (en pajuela) y la vitrificación ultrarrápida. Aunque la criopreservación de embriones producidos in vitro se puede abordar por técnicas de congelación lenta, se asume que la vitrificación es la herramienta de elección para estos embriones.
La
congelación lenta (que utiliza bajas concentraciones de agentes crioprotectores) de los embriones producidos
in vitro reduce su supervivencia en comparación con los embriones obtenidos
in vivo, debido principalmente a la mayor susceptibilidad de aquéllos a la formac
ión de cristales de hielo que dañan la estructura de los órganos celulares.
La vitrificación permite mejorar la supervivencia del embrión tras la desvitrificación (Vajta et al., 2000) al producir menor estrés metabólico en los embriones, dando lugar a mayores porcentajes de gestación tras su transferencia a receptoras. Estos efectos beneficiosos de la vitrificaciónse deben a una reducción de los daños producidos por el frío, al utilizarse altas concentraciones de agentes crioprotectores y elevadas velocidades de enfriamiento y calentamiento, con lo que se evita la formación de cristales de hielo y se reducen los tiempos de exposición de la célula al crioprotector (Rall and Fahy, 1985).
Las técnicas de vitrificación ultrarrápida, desarrolladas recientemente, han estimulado los avances en el campo de la criopreservación de gametos y embriones, con especial relevancia en el caso de la preservación de especies en riesgo de extinción, dados los resultados positivos obtenidos especialmente en el caso de los embriones producidos in vitro y de los ovocitos.
Para que la vitrificación sea eficaz se precisa que la exposición a la solución crioprotectora dure el menor tiempo posible (Gardner et al., 2007) y disponer el ovocito o el embrión en volúmenes muy reducidos de medio (0,5-2µL de medio). Así, técnicas como Open Pulled Straw (OPS), Solid Surface Vitrification (SSV), cryoloop, cryotop, Vitmaster, o fiberplugs (ver revisión por Gardner et al., 2007) se usan rutinariamente en muchos laboratorios de fecundación in vitro. Sin embargo, la técnica de vitrificación presenta dos limitaciones importantes:
· La desvitrificación requiere diluir y retirar el agente crioprotector antes de transferir el embrión. Las condiciones de manipulación (temperatura ambiental -39ºC-, temperatura de las soluciones de desvitrificación -41ºC-, dilución en soluciones con concentraciones decrecientes de sacarosa) son difíciles de establecer en las granjas, extremo muy importante en el caso del ganado vacuno.
· La técnica no es sanitariamente segura. Debe tenerse en cuenta el riesgo potencial de que se produzcan contaminaciones cruzadas, especialmente si se almacenan conjuntamente embriones y/o gametos de diferentes especies. Este aspecto cobra especial importancia, también, en el caso de los Bancos de Recursos Zoogenéticos. Sin embargo, en la actualidad se han modificado algunos de los protocolos y se están utilizando recipientes estancos capaces de albergar y aislar perfectamente el embrión u ovocito.
Vitrificación de embriones. © SERIDA
Biotecnologías reproductivas desarrolladas en el SERIDA
El Área de Genética y Reproducción Animal del SERIDA realiza, desde hace casi dos décadas, una intensa actividad investigadora en el campo de las nuevas biotecnologías reproductivas.
Los proyectos de investigación desarrollados han permitido la puesta a punto de la técnica de Ovum Pick-Up (OPU), así como la de vitrificación (sistema clásico en pajuela) de los embriones. Estos trabajos cristalizaron en la obtención de los primeros terneros nacidos en España, tras la transferencia de embriones producidos in vitro y conservados por vitrificación. Así, Pelayo y Cova fueron los primeros terneros nacidos tras aplicar la técnica OPU y Xicu y Marina, los primeros que se obtuvieron tras aplicar la técnica de vitrificación.
Además, se abordó el estudio de la repercusión de los sistemas de producción de embriones in vitro sobre sus características criobiológicas con el fin de diseñar un sistema de cultivo capaz de permitir un óptimo desarrollo embrionario y que, combinado con un adecuado sistema de vitrificación nos permitiera obtener embriones in vitro que sobrevivieran a la criopreservación en porcentajes superiores al 50%. En la actualidad, el método de vitrificación clásico ha sido sustituido por métodos de mínimo volumen, y los embriones producidos in vitro son vitrificados por la técnica OPS o en Fiberplugs, con elevados porcentajes de supervivencia in vitro.
El mejor índice de calidad embrionaria es la constatación de que la transferencia de los embriones a las receptoras se traduzca en gestaciones, lo cual es una condición necesaria para lograr una completa expansión de las tecnologías in vitro. Para ello, durante el último semestre de 2010 se están realizando transferencias de embriones producidos in vitro, con semen sexado, en fresco o tras vitrificación, y que servirán para comprobar si los resultados de supervivencia in vitro obtenidos permiten aplicar adecuadamente la técnica en la granja.
Las líneas de investigación actuales en criobiología, pasan por mejorar la calidad embrionaria ,previa a la vitrificación junto con la utilización de semen sexado para producir embriones de sexo conocido. Todo ello, se enmarca en un programa de investigación que estudia el desarrollo embrionario bovino in vitro e in vivo, con el fin de aumentar los índices de establecimiento de gestaciones del sexo deseado y de mejorar la supervivencia y la salud de los animales nacidos.
Además de la criopreservación de embriones bovinos producidos in vitro, línea que también se extiende a los ovocitos bovinos, otras líneas de investigación en curso son las siguientes:
· Identificación, aislamiento y análisis funcional de proteínas del medio uterino para su incorporación a medios de cultivo in vitro.
· Desarrollo de técnicas no invasivas para predecir los índices de gestación de embriones y receptoras, y el sexo de los embriones cultivados.
· Utilización de la microscopía de luz polarizada como técnica no invasiva para evaluar la calidad de los ovocitos en especies domésticas.
· caracterización de líneas celulares pluripotentes en ganado bovino.
Congelador programable para embriones. © SERIDA
Agradecimientos
B. Trigal, CajAstur. E. Correia, Ministerio de Ciencia e Innovación (MICIN). S. Carrocera, D. Martín MICIN-Fondo Social Europeo. Instituto Nacional de Investigación y Tecnología Agraria y Alimentaria (INIA) proyectos: RTA2008-0082 y RZ2008-0014.
Bibliografía
AETE. National Statistic Data of the Embryo Transfer Activity. 25th Scientific Meeting of the AETE, Poznan (Polland), September, 2009 pp 67.
Gardner DK, Sheehan CB, Rienzi L, Katz-Jaffe M. Larman MG. Analysis of oocyte physiology to improve cryopreservation procedures. Theriogenology 2007 67: 64-72.
Gómez E, Rodríguez A, Muñoz M, Caamaño JN, Hidalgo CO, Morán E, Facal N, Díez C. Serum free embryo culture medium improves in vitro survival of bovine blastocysts to vitrification. Theriogenology 2008 69:1013-1021.
Hasler JF, Henderson WB, Hurtgen PJ, Jin ZQ, McCauley AD, Mower SA, Neely B, Shuey LS, Stokes JE, Trimmer SA. Production, freezing and transfer of bovine IVF embryos and subsequent calving results. Theriogenology 1995;43:141-152.
Kruip ThAM, Boni R, Wurth YA, Roelofsen MWM, Pieterse MC. Potential use of ovum pick-up for embryo production and breeding in cattle. Theriogenology 1994 42:675-684.
Leibo SP, Loskutoff NM. Cryobiology of in vitro-derived bovine embryos. Theriogenology 1993 39: 81-94.
Leibo SP, Martino A, Kobayashi S, Pollard JW. Stage-dependent sensibility of oocytes and embryos to low temperatures. Anim Reprod Sci 1996 42:45-53.
Lonergan P, Rizos D, Ward F, Boland MP. Factors influencing oocyte and embryo quality in cattle. Reprod Nutr Dev 2001 41:427-437.
Lonergan P. State-of-the-art embryo technologies in cattle. Soc Reprod Fertil (Suppl) 2007 64:315-325.
Rall WF, Fahy GM. Ice-free cryopreservation of mouse embryos at −196◦C by vitrification. Nature 1985 313:573-575.
Rizos D, Gutiérrez-Adán A, Pérez-Garnelo S, de la Fuente J, Boland MP, Lonergan P. Bovine embryo culture in the presence or absence of serum: implications for blastocyst development, cryotolerance, and messenger RNA expression. Biol Reprod 2003 68:236-243.
Rizos D., Clemente M., Bermejo-Álvarez, P., de la Fuente, J., Lonergan, P. and Gutiérrez-Adán, A. Consequences of in vitro culture conditions on embryo development and quality. Reprod Dom Anim 2008; 43 (Supl. 4): 44-50.
Vajta G. Vitrification of the oocytes and embryos of domestic animals. Anim Reprod Sci 2000;60-61:357-364.
Wilmut I, Rowson LE. Experiments on the low-temperature preservation of cow embryos. Vet Rec. 1973 92(26):686-690.
Wrenzycki C, Herrman D, Lucas-Hahn A, Korsawa K, Lemme E, Niemman H. Messenger RNA expression patterns in bovine embryos derived from in vitro procedures and their implications for development. Reprod, Fert Dev 2005 17:23-35.