Publicaciones SERIDA
Sumario
El rendimiento del cultivo de kiwi depende de una buena polinización por insectos
MARCOS MIÑARRO PRADO. Área de Cultivos Hortofrutícolas y Forestales. Programa de Fruticultura. mminarro@serida.org
ROCÍO ROSA GARCÍA. Área de Nutrición, Pastos y Forrajes. rocior@serida.org
DANIEL GARCÍA GARCÍA. Departamento de Biología de Organismos y Sistemas. Universidad de Oviedo. Instituto Mixto de Investigación en Biodiversidad (CSIC- Universidad de Oviedo- Principado de Asturias). danielgarcia@uniovi.es
Nuevos biomarcadores para la detección temprana de defectos de calidad en la carne de vacuno
LAURA GONZÁLEZ BLANCO. Área de Sistemas de Producción Animal. lgblanco@serida.org
VERÓNICA SIERRA SÁNCHEZ. Área de Sistemas de Producción Animal. veroniss@serida.org
YOLANDA DIÑEIRO GARCÏA. Área de Sistemas de Producción Animal. ydineiro@serida.org
PEPA GARCÍA ESPINA. Área de Sistemas de Producción Animal. mjgarcia@serida.org
MAMEN OLIVÁN GARCÍA. Área de Sistemas de Producción Animal. mcolivan@serida.org
Introducción
El sector cárnico ocupa el primer lugar de la industria española de alimentos y bebidas, representando una cifra de negocio de 26.882 millones de euros que constituye el 22,6% de todo el sector alimentario español y supone aproximadamente el 2,24% del PIB nacional (según datos de la Asociación Nacional de Industrias de la Carne de España (ANICE)).
La calidad de la carne es un concepto multifactorial que depende de factores intrínsecos al animal como la raza, la genética, el sexo, la edad o el tipo de músculo, pero también extrínsecos como las condiciones de alimentación y cría, el transporte y manejo de los animales antes y durante el sacrificio, así como el manejo de las canales y la carne post-mortem (Adzitey y Nurul, 2011; Ponnanpalam y cols. 2017). Gran parte de los defectos de calidad están relacionados con situaciones de manejo que producen estrés animal antes y/o durante el sacrificio, que afectarán en mayor o menor grado, dependiendo de la susceptibilidad individual de los animales, a los procesos fisiológicos y al metabolismo muscular, alterando el proceso de conversión del músculo en carne, lo que conllevará efectos negativos sobre la calidad final de la carne. Por otro lado, en las últimas décadas las estrategias de producción animal se han dirigido hacia la obtención de animales de crecimiento rápido y alta producción cárnica, lo que generalmente va acompañado de menores reservas de glucógeno (almacén natural de carbohidratos) en el músculo, aspecto éste que también resulta perjudicial para la calidad final del producto.
Los problemas de calidad de la carne que mayor rechazo generan en los consumidores, son defectos que afectan al color o a la capacidad de retención de agua y que producen un impacto negativo en la intención de compra. Uno de los defectos visibles más comunes en la carne de bovino son los cortes oscuros o carnes DFD (del inglés Dark, Firm and Dry, es decir, Oscura, Dura y Seca). La aparición de carnes DFD se asocia con situaciones de estrés animal, o a una actividad muscular excesiva en momentos previos al sacrificio, lo que conlleva un agotamiento temprano de las reservas de glucógeno, debido al esfuerzo que realizan las células musculares para responder a estas situaciones consumiendo grandes cantidades de glucosa y oxígeno. Este agotamiento hace que la glicolisis anaerobia (ruta celular que ocurre en el tejido muscular, tras el sacrificio del animal, para conseguir energía cuando se corta el aporte de oxígeno y nutrientes a la célula) se vea interrumpida de forma temprana, con lo que se reduce la acumulación de ácido láctico (producto de la glicolisis anaerobia) y se produce un descenso anómalo del pH post-mortem, que se mantiene en valores superiores a 6 a las 24h del sacrificio, mientras que en condiciones normales alcanza valores en torno a 5.4-5.6 (Ponnanpalam y cols., 2017). Todos estos sucesos influyen de forma negativa en el proceso de conversión del músculo en carne, dando lugar a carnes oscuras, secas, de textura anómala y más susceptibles al deterioro microbiano (es decir, las carnes DFD) lo que reduce considerablemente su vida útil.
De forma general se estima que, a nivel mundial, hasta un 10% de carnes de vacuno presentan este tipo de defectos de calidad (DFD), que en casos leves devalúan el precio de las canales entre un 30 y un 60% pero que en casos severos producen el rechazo total del producto, lo que supone un importante problema económico para el sector, además de un grave problema de desperdicio alimentario.
Por ese motivo se está desarrollando en el SERIDA el proyecto SMARTBEEF, financiado por el Ministerio de Ciencia e Innovación del Gobierno de España, cuyo objetivo principal es abordar el estudio de los procesos biológicos que causan la aparición de carnes DFD con el fin de identificar nuevos biomarcadores y herramientas analíticas que puedan ser utilizadas en la industria cárnica para una detección temprana de la calidad de la carne. En este trabajo mostramos los resultados obtenidos del estudio de moléculas relacionadas con el metabolismo celular, que pueden ser medidas en el tejido muscular en las primeras horas tras el sacrificio del animal y que podrían utilizarse como biomarcadores para la detección temprana de defectos de calidad.
Biomarcadores relacionados con los procesos de estrés oxidativo
Tras el sacrificio del animal, las fibras musculares se ven sometidas a una situación de isquemia (carencia de oxígeno y nutrientes) que eleva los niveles de estrés oxidativo celular y conduce a la acumulación de especies reactivas de oxígeno (EROs), que alteran el equilibrio redox y pueden causar daños oxidativos celulares (Bekhit y cols., 2013). Se ha demostrado que cuanto mayor es el nivel de estrés al que se ve sometido un animal, mayor producción de EROs y mayor daño oxidativo se producirá en sus tejidos (Li y cols., 2011). Ante esta situación, las células están dotadas de varios sistemas de defensa, como los enzimas antioxidantes, que funcionan como mecanismos de prevención del daño celular inducido por las EROs (Delles y cols., 2014).
Teniendo esto en cuenta, se planteó la hipótesis de que el análisis de la actividad de los sistemas de defensa antioxidante celular podrían ser interesantes biomarcadores de estrés. Por ese motivo, se analizó la actividad de los enzimas antioxidantes catalasa (CAT) y superóxido dismutasa (SOD) en carnes DFD y en carnes de calidad normal (CONTROL) de terneros añojos culones.
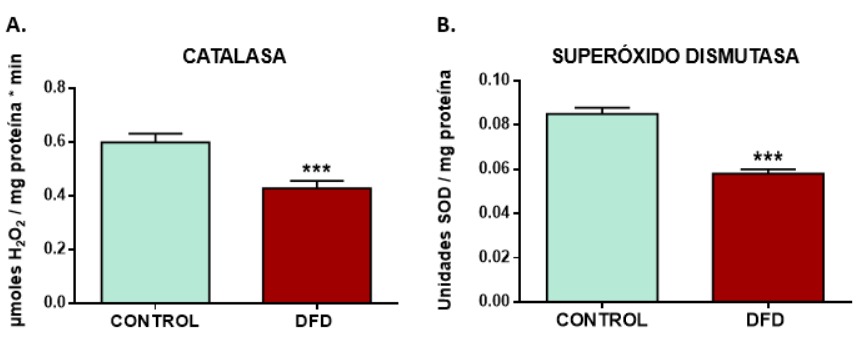
Los resultados se muestran en la Figura 1 y demuestran que había una actividad significativamente menor (P < 0,001) de los enzimas antioxidantes CAT y SOD en las carnes DFD, lo que indica una menor defensa antioxidante, probablemente debido a la activación más temprana e intensa del metabolismo celular post-mortem en respuesta al estrés previo al sacrificio, lo que resulta en un agotamiento de los sistemas de defensa antioxidante naturales. Esto producirá en el tejido muscular DFD mayor susceptibilidad a sufrir reacciones oxidativas, y por tanto un aumento de las EROs y del daño oxidativo, lo que produce los defectos de calidad observados.
Otro biomarcador celular de posible aplicación para la detección de las carnes DFD son las proteínas de choque térmico (Heat Shock Proteins, HSPs), en concreto la HSP70 y HSP90, por su importante papel en la protección de las células y los organismos frente al daño oxidativo (Zhang y cols., 2021). Diferentes estudios proteómicos, han demostrado que las HSPs tienen una expresión diferencial en función de la raza, el sistema de producción y los rasgos de calidad de la carne (Xing y cols., 2015; Sierra y cols., 2021). Además, los niveles de HSPs en el músculo post-mortem temprano se han relacionado con los procesos de muerte celular, que influyen en el proceso de conversión del músculo en carne (Fuente-García y cols., 2019). Esto ha sido demostrado por varios autores (Zhang y cols., 2021; Ouali y cols., y 2013), que descubrieron que la síntesis de HSP70 y HSP90 en condiciones de estrés desempeña un papel protector en el mantenimiento de la homeostasis (equilibrio metabólico) y la integridad estructural de las células musculares contra los daños, ralentizando la apoptosis y la tasa de degradación de las proteínas miofibrilares del músculo, lo que afecta a la velocidad de ablandamiento o tenderización de la carne, y por lo tanto a su textura.
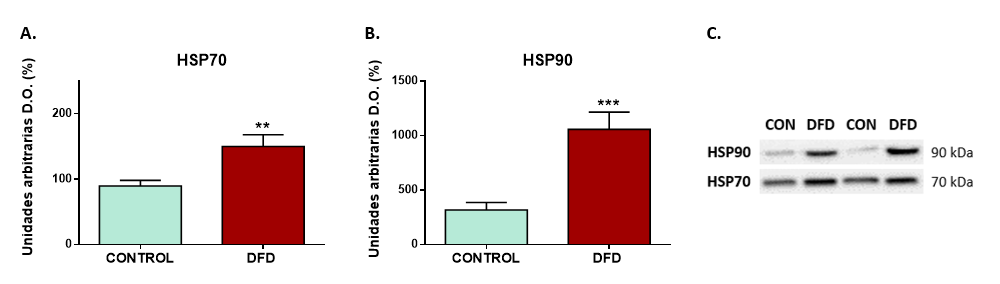
Los resultados de la actividad de las HSPs en nuestro estudio (Figura 2) han mostrado niveles significativamente superiores de expresión de la HSP70 (P < 0,01) y la HSP90 (P < 0,001) en la carne DFD que en la carne de calidad normal (CONTROL). Esto parece indicar que el estrés previo al sacrificio, en los animales que producen la carne DFD, promueve la sobreexpresión de las HSPs en un intento de restaurar la homeostasis (equilibrio) celular. Esta sobreexpresión de las HSPs en el músculo de las canales DFD podría influir en el proceso normal de conversión del músculo en carne, con un retraso de la señalización apoptótica (muerte celular), alterando el proceso normal de proteólisis (rotura de proteínas) en las células musculares, con efectos negativos en la calidad final de la carne.
El retículo endoplasmático celular: un orgánulo clave en situaciones de estrés
En situaciones en que el daño oxidativo es alto, el estrés oxidativo altera la función normal de los orgánulos celulares. Entre éstos, el retículo endoplásmico (RE), es considerado uno de los más importantes en la regulación de la respuesta celular al estrés (Wang y Kaufman, 2016), ya que es el principal orgánulo celular implicado en la síntesis y el plegado de proteínas, así como en el almacenamiento de calcio intracelular, todo ello muy relacionado con el metabolismo celular involucrado en el proceso de conversión del músculo en carne.
Este estudio es el primero a nivel mundial que propone analizar el papel del RE en el proceso de conversión del músculo en carne. El estrés del RE se produce cuando el desequilibrio redox celular conduce a la acumulación de proteínas desplegadas o mal plegadas, que afectan a la función fisiológica normal del RE. Esta situación activa una cascada de señalización intracelular denominada Respuesta a Proteínas Desplegadas (Unfolded Protein Response, UPR) cuya función es restaurar el funcionamiento normal de la célula, deteniendo la traducción de proteínas y activando las vías de señalización que permitan incrementar la producción de chaperonas moleculares involucradas en el plegamiento de las proteínas. Si la célula no consigue restaurar la homeostasis y lograr la supervivencia celular, la UPR se dirige hacia procesos de muerte celular programada como la apoptosis (Uguz y cols., 2009), los cuales tal y como se ha demostrado previamente, influyen en la calidad final de la carne (García-Macía y cols., 2014; Fuente-García y cols., 2019; Díaz y cols., 2020).
En nuestro estudio se han analizado tres proteínas transmembrana que pueden promover la UPR a través de cascadas de acción independientes: ATF6α (en inglés Activating Transcription Factor 6α), IRE1α (en inglés Inositol-Requiring Enzyme 1α) y PERK/eIF2α (en inglés RNA-dependent protein kinase-like ER/eukaryotic translation initiation factor 2α). Los resultados obtenidos muestran que en las carnes DFD la respuesta del RE al estrés fue más intensa, mostrando mayor expresión de IRE1α (P < 0,001) y p-eIF2α (P < 0,01) que las carnes CONTROL, mientras que para ATF6α, no se encontraron diferencias significativas. La mayor expresión de IRE1α (implicada en la degradación de proteínas mal plegadas) y p-eIF2α (implicada en la detención de la síntesis proteica), parecen reacciones orientadas a aliviar el estrés del RE.
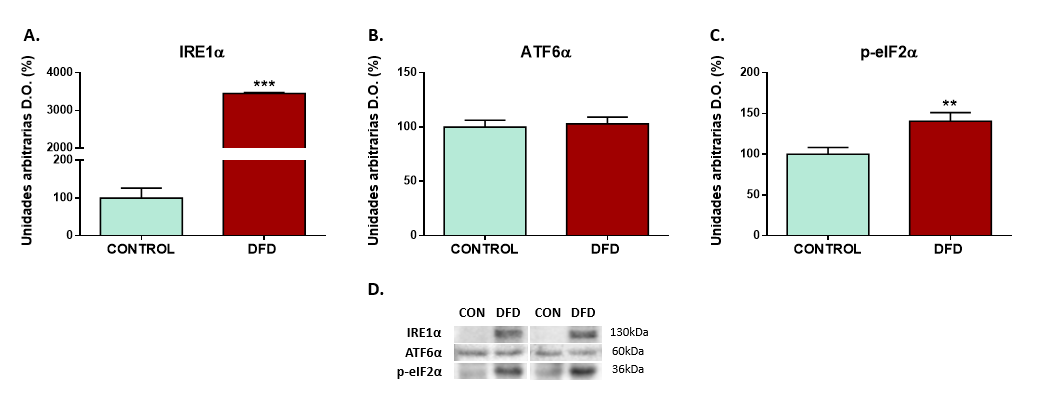
Este aumento de la activación de la UPR observado a las 24h post-mortem en las carnes DFD indica mayores niveles de estrés en el RE de estos animales. Incrementos en la UPR han sido asociados previamente con mayor intensidad de un tipo de muerte celular conocido como autofagia (Yorimitsu y cols., 2007), proceso que es más intenso en las carnes DFD (Díaz-Luis y cols., 2021). Estos mecanismos celulares diseñados para mantener la homeostasis celular a pesar del daño oxidativo (incremento de autofagia como tipo de muerte celular orientado al reciclaje y sustitución de orgánulos dañados) que son inducidos por el estrés previo al sacrificio, parecen retardar el inicio de la apoptosis (tipo de muerte celular que elimina de forma selectiva las células dañadas), lo que conduciría a un proceso de tenderización anómalo y por tanto a la aparición de los defectos de calidad en la carne.
Conclusiones
La carne con defectos de calidad DFD muestra importantes diferencias respecto a la carne de calidad normal en distintos biomarcadores de los procesos celulares de respuesta al estrés oxidativo. Este estudio nos ha permitido demostrar que la carne DFD muestra a las 24 horas post-mortem una menor capacidad antioxidante, una mayor expresión de proteínas de estrés (HSPs) y una mayor activación de proteínas de la UPR (respuesta al estrés oxidativo del retículo endoplasmático), lo que en conjunto indica un aumento de la respuesta celular al estrés oxidativo y un retraso del proceso post-mortem normal de muerte celular, conocido como apoptosis, lo que conduce a un proceso anormal de conversión del músculo en carne que da lugar a una carne defectuosa. Estos resultados parecen indicar que una monitorización de la presencia y de la evolución de los principales biomarcadores de estrés oxidativo (actividad de las enzimas Superóxido Dismutasa “SOD” y Catalasa “CAT” y de enzimas de estrés HSPs) y de la respuesta al estrés del RE (IRE1α, ATF6α y p-eIF2α) puede servir para detectar situaciones de estrés animal, así como para predecir la calidad final de la carne.
Agradecimientos
Este trabajo ha sido financiado por el Ministerio de Ciencia, Innovación y Universidades (MCIU) (España), Agencia Estatal de Investigación (España) y fondos FEDER, bajo el número de proyecto RTI2018-096162-RC21. Laura González Blanco agradece la financiación de su contrato PRE2019-091053. Agradecemos al personal del Área de Sistemas de Producción Animal del SERIDA, Matadero Central de Asturias S. L., Alimerka S. L., ASINCAR y al personal de ASEAVA su inestimable colaboración.
Referencias
ADZITEY, F.; NURUL H. Pale soft exudative (PSE)and dark firm dry (DFD) meats: Causes and measures to reduce these incidences-A mini review. Int. Food Res. J. 2011, 18, 11- 20.
BEKHIT, A.E.A.; HOPKINS, D.L.; FAHRI, F.T., y cols. Oxidative Processes in muscle systems and fresh meat: sources, markers, and remedies. Compr Rev Food Sci Food Saf. 2013, 12, 565-597.
DELLES, R.M.; XIONG, Y.L., TRUE, A.D., y cols. Dietary antioxidant supplementation enhances lipid and protein oxidative stability of chicken broiler meat through promotion of antioxidant enzyme activity. Poult Sci. 2014, 93, 1561-1570.
DÍAZ, F., DÍAZ-LUIS, A., SIERRA, V., y cols. What functional proteomic and biochemical analysis tell us about animal stress in beef? J. Proteomics 2020, 218, 103722.
DÍAZ-LUIS, A.; DÍAZ, F.; DIÑEIRO, Y., y cols. Nuevos indicadores de carnes (DFD): Estrés oxidativo, autofagia y apoptosis. ITEA, 2021, 117, 3-18.
FUENTE-GARCÍA, C.; ALDAI, N.; SENTANDREU, E., y cols. Search for proteomic biomarkers related to bovine pre-slaughter stress using liquid isoelectric focusing (OFFGEL) and mass spectrometry. J Prot. 2019, 198, 59-65.
GARCÍA-MACÍA, M.; SIERRA, V.; PALANCA, A., y cols. Autophagy during beef aging. Autophagy 2014, 10, 137-143.
LI Q.; ZHANG, M.; CHEN, Y.J., y cols. Oxidative damage and HSP70 expression in masseter muscle induced by psychological stress in rats. Physiol Behav. 2011, 104, 365-372.
OUALI, A.; GAGAOUA, M.; BOUDIDA, Y., y cols. Biomarkers of meat tenderness: Present knowledge and perspectives in regards to our current understanding of the mechanisms involved. Meat Sci. 2013, 95, 854-870.
PONNAMPALAM, E.N.; HOPKINS, D.L.; BRUCE, H., y cols. Causes and contributing factors to “dark cutting” meat: current trends and future directions: a review. Compr. Rev. Food Sci. Food Saf. 2017, 16, 400-430.
SIERRA, V.; GONZÁLEZ-BLANCO, L.; DIÑEIRO, Y., y cols. New Insights on the Impact of Cattle Handling on Post-Mortem Myofibrillar Muscle Proteome and Meat Tenderization. Foods 2021, 10, 3115.
UGUZ, A.C.; NAZIROGLU, M.; ESPINO, J., y cols. Selenium Modulates Oxidative Stress-Induced Cell Apoptosis in Human Myeloid HL-60 Cells Through Regulationof Calcium Release and Caspase-3 and -9 Activities. J. Membrane Biol. 2009, 232, 15-23.
WANG, M.; KAUFMAN, R.J. Protein misfolding in the endoplasmic reticulum as a conduit to human disease. Nature 2016, 529, 326- 335.
XING, T.; XU, X.L.; ZHOU, G.H., Y COLS. The effect of transportation of broilers during summer on the expression of heat shock protein 70, postmortem metabolism and meat quality. J Anim Sci. 2015, 93, 62-70.
YORIMITSU, T.; KLIONSKY, D.J. Endoplasmic reticulum stress: a new pathway to induce autophagy. Autophagy 2007, 3, 160-162.
ZHANG, M.; WANG, D.; XU, X., y cols. Evaluation of antioxidant property of heat shock protein 90 from duck muscle. Anim Biosci. 2021, 34, 724-733.
| Ficha Bibliográfica | |
|---|---|
| Título | Nuevos biomarcadores para la detección temprana de defectos de calidad en la carne de vacuno |
| Autor/es | LAURA GONZÁLEZ BLANCO. Área de Sistemas de Producción Animal. lgblanco@serida.org VERÓNICA SIERRA SÁNCHEZ. Área de Sistemas de Producción Animal. veroniss@serida.org YOLANDA DIÑEIRO GARCÏA. Área de Sistemas de Producción Animal. ydineiro@serida.org PEPA GARCÍA ESPINA. Área de Sistemas de Producción Animal. mjgarcia@serida.org MAMEN OLIVÁN GARCÍA. Área de Sistemas de Producción Animal. mcolivan@serida.org |
| Año Publicación | 2022 |
| Área | |
| Revista/Serie | Tecnología Agroalimentaria. Boletín Informativo del SERIDA. |
| Referencia | Nº26. Pags 25-30 |
| Formato | Artículo divulgativo |
| Depósito Legal | 1.617/1995 |
| ISSN | 1135-6030 |
| ISBN | |
| Ver/Descargar | |

