Publicaciones SERIDA
La sarna sarcóptica en especies domésticas y silvestres del Principado de Asturias. Diagnóstico y vacunas
ROSA CASÁIS GOYOS. Área de Sanidad Animal. Centro de Biotecnología Animal de Deva. rosacg@serida.org

La sarna sarcóptica es una ectoparasitosis de distribución mundial causada por el ácaro Sarcoptes scabiei (artrópodo miembro de la clase Arácnida, subclase Acari, orden Astigmata y familia Sarcoptidae) (Figura 1). Se trata de una patología de la piel altamente contagiosa, de gran relevancia económica, ecológica y sanitaria en poblaciones humanas, de ganado doméstico y fauna silvestre. Es una zoonosis, una enfermedad infecciosa que se transmite de forma natural de animales al hombre, afectando a más de 300 millones de personas en el mundo (WHO, 2001). La sarna humana prevalece sobre todo entre las clases socioeconómicas pobres, malnutridas y con condiciones higiénicas inadecuadas. La enfermedad es endémica entre los miembros de algunas comunidades aborígenes de la zona norte y central de Australia, en las cuales el 50% de los niños pueden estar infectados con S. scabiei (Hamural y col. 2003). Además, la enfermedad afecta a un amplio rango de mamíferos domésticos y silvestres (Elgart, 1990; Zahler y col., 1999). En el ganado, el intenso prurito asociado con la enfermedad interfiere con la producción de leche, la ganancia de peso y la calidad de los cueros, lo que, junto con los costes ocasionados por el uso continuado de acaricidas en los rebaños afectados, ocasiona importantes pérdidas económicas (Rehbein, 2003). Asimismo, la sarna sarcóptica juega un papel importante en la dinámica de varias especies silvestres, alcanzando nivel epizoótico en algunas poblaciones (Pence y Ueckermann, 2002). En especies amenazadas, esta enfermedad tiene gran relevancia ya que puede diezmar poblaciones aisladas contribuyendo incluso a su desaparición.
Existe una elevada especificidad parásito-hospedador entre el ácaro y las diferentes especies a las que parasita, de tal modo que algunos autores llegan a describir diferentes variedades (hominis, bovis, ovis, caprae, cervi, canis) morfológicamente indistinguibles. Las distintas variedades de S. scabiei (var. suis, hominis y canis) están relacionadas antigénicamente, aunque también se han descrito epítopos específicos de cada variedad (Arlian et al., 1996).
En especies animales la enfermedad se transmite por contacto directo con animales enfermos, o indirecto a través de zonas comunes de refugio y rascaderos. El ácaro S. scabiei excava túneles en la epidermis del hospedador depositando material antigénico que ocasiona irritación y una fuerte respuesta inflamatoria que dan lugar a lesiones cutáneas características. Los efectos que la enfermedad produce en cada animal están modulados por factores individuales (especie hospedadora, sexo, edad, condición física y estado inmunitario) y ambientales (densidad de hospedadores, uso de zonas comunes de rascado y reposo, presencia de individuos u otras especies hospedadoras que actúan como reservorio). Las formas clínicas agudas producen prurito, eritema, pápulas, seborrea y alopecia mientras que en los casos crónicos se observan costras, hiperqueratosis, engrosamiento y grietas en la piel que pueden provocar deshidratación, emaciación y eventualmente la muerte del animal.
La sarna puede manifestarse patológicamente de dos formas diferentes, la paraqueratótica, compatible con una respuesta de hipersensibilidad tipo I (inmediata) y la forma alopécica relacionada con una respuesta de hipersensibilidad tipo IV (retardada) (Skerratt, 2003). Oleaga y col. (2012) realizaron un estudio patológico e inmunohistoquímico comparativo de la sarna sarcóptica en cinco especies simpátricas (rebeco, ciervo, corzo, lobo y zorro) del norte de España. El lobo es la única especie en la que se observó un predominio de una respuesta de hipersensibilidad tipo IV (alopecia) frente a la forma hiperqueratótica observada en ungulados y zorros.
En España, la sarna ha sido descrita en la mayoría de las especies de animales domésticos. Es una enfermedad endémica de la producción porcina, es la ectoparasitosis más importante que afecta a esta especie provocando importantes pérdidas económicas (Zimmermann y Kircher, 1998), entre el 50-90% de las explotaciones están afectadas (Cargill et al., 1997). Igualmente, ha sido descrita en un alto número de especies silvestres, tales como la cabra pirenaica (Capra pirenaica), el ciervo (Cervus elaphus) y el corzo (Capreolus capreolus) (Fernández Morán y col., 1997; González-Candela y col., 2004; Oleaga y col., 2008a). La epizootia de sarna de mayor magnitud sobre poblaciones de animales silvestres es la que afecta a la cabra montesa (Capra pirenaica hispánica) del Parque Natural de Cazorla, Segura y las Villas (Jaén) (León-Vizcaíno y col., 1999) desde 1988 que provocó la muerte de más del 90% de la población y que se ha extendido a otras zonas geográficas ocupadas por la especie.

En Asturias, la enfermedad alcanzó especial relevancia debido a la epidemia de sarna que afecta al rebeco cantábrico (Rupicapra pirenaica parva) desde 1993 (Figura 2). El primer brote de la enfermedad en esta especie emblemática de Asturias se detectó en la Reserva Regional de Caza de Aller, en las inmediaciones del Pico Torres. Desde allí se extendió lentamente hasta afectar a la mayor parte del Parque de Redes (Caso) y llegó hasta el municipio de Lillo (León), convirtiéndose en la epizootia de sarna más importante que se ha descrito en nuestra región (González Quirós y col., 2002a). En años posteriores, el número de rebecos con sarna en la zona ha seguido una tendencia decreciente (González-Quirós y col, 2002b), sin embargo, la enfermedad se ha detectado también en el Parque Nacional de los Picos de Europa. En el año 2006 la población de rebecos representaba el 35,9% de la existente en 1995 (Fernández-Morán y col, 1997; González-Quirós y col., 2002a, b). En Asturias la sarna ha sido diagnosticada también en otras especies de ungulados silvestres (ciervos, corzos), zorros, lobos y en animales domésticos (cabras).
La cabra es, sin duda, en nuestra región el rumiante doméstico en el que se han diagnosticado un mayor número de brotes de sarna. De hecho, se ha sugerido que la epidemia de sarna en el rebeco tuvo su origen en cabras domésticas que compartían el hábitat con la especie silvestre y estaban infectadas por S. scabiei, (Lavín, 1998; Lavín y col., 2000).
Diagnóstico
El diagnóstico clínico de la sarna se basa en la observación de los signos clínicos, el comportamiento (raspados y sacudidas) y las lesiones que presenta el animal. Sin embargo, para realizar un diagnóstico definitivo de la enfermedad es necesario aislar el parásito, mediante raspados o biopsias de piel. No obstante, el aislamiento de ácaros resulta a menudo infructuoso. Así, en cánidos solamente se encuentran parásitos en el 20-30% de los animales afectados (Arlian y col., 1995). En ganado porcino, la enfermedad puede cursar de forma subclínica sin aparición de lesiones evidentes en la piel de forma que la ausencia de ácaros no es fácil de determinar (Matthes y col., 1990). De la misma forma, en animales silvestres abatidos durante las cacerías, las pequeñas lesiones específicas de sarna pasan a menudo desapercibidas. Por lo tanto, es importante resaltar la necesidad de nuevos métodos de diagnóstico para monitorizar, analizar y posiblemente predecir la expansión y los efectos de la sarna en el ámbito de cada población.
Una alternativa al diagnóstico clásico de la sarna es la detección de anticuerpos contra S. scabiei en el suero de los animales infectados mediante un test serológico. Los ácaros de S. scabiei inducen una respuesta inmunológica específica frente al parásito en los animales parasitados, la cual puede ser detectada mediante un ensayo inmunológico tipo ELISA (Bornstein y Wallgren, 1997; Van der Heijden y col., 2000; Lower y col., 2001; Rambozzi y col., 2004). En este sentido, se han desarrollado ELISAs basados en preparados totales de antígeno crudo derivado de ácaros de distintas variedades de S. scabiei (Curtis, 2001). Sin embargo, la sensibilidad varía enormemente entre los distintos ELISAs e incluso entre los distintos lotes de un mismo ensayo (Kessler y col., 2003).
En el año 2006, con el fin de evitar los problemas derivados del uso de esos preparados antigénicos complejos, el SERIDA y la Universidad de Oviedo, desarrollaron un ensayo tipo ELISA indirecto basado en la detección de anticuerpos específicos frente al antígeno Ssλ20∆B3. Se utilizaron técnicas de Biología Molecular para identificar, aislar y expresar el gen codificador de un antígeno específico (Ssλ20∆B3) de S. scabiei en la bacteria Escherichia coli (Casais y col., 2007). La figura 3 muestra la localización de este antígeno en el ácaro. El uso de antígeno recombinante evita la necesidad de recurrir a ácaros de animales infectados -portadores del antígeno natural- lo que abarata los costes de producción y podría permitir un diagnóstico más precoz de esta parasitosis.
Este ensayo ha sido utilizado, adaptado y validado para el diagnóstico de esta zoonosis en varias especies domésticas y silvestres en las que la enfermedad tiene gran repercusión (Tabla 1).
| Especie | N | PC (%) | Sensibilidad (%) | Especificidad (%) | Artículos |
| Rebeco Cantábrico | 40 | 16 | 100 | 97 | Casais y cols. (2007) |
| Ciervo | 41 | 43 | 75 | 97 | Casais y cols. (2007) |
| Ciervo | 418 | 43 | 75 | 100ª y 98,77b | Oleaga y cols. (2008) |
| Lobo | 15 | 8,9 | 75 | 87,5 | Oleaga y cols.(2008) |
| Cabra Montés | 117 | 10,4 | 58,1 | 78,4 | Ráez-Bravo y cols. (2016) |
| Conejo silvestre | 78 | 6,7 | 100 | 90,54 | Casais y cols. (2015) |
| Cerdas reproductoras | 432 | 7,2 | 62 | 83 | Casais y cols. (2013) |
| Cerdas engorde | 225 | 0,2 | 40 | 86 | Casais y cols. (2013) |
| Conejo doméstico (exp) | 12 | 3 | 100 | 100 | Casais y cols. (2015) |
| Conejo doméstico (granja) | 83 | 3 | 95,12 | 97,62 | Casais y cols. (2015) |
|
PC indica el punto de corte del ELISA para esa especie ((porcentaje de densidad óptica relativa por encima del cual los animales se consideran positivos); N indica el número total de animales utilizados en la validación de la técnica; ª se refiere a zonas no afectadas por la sarna sarcóptica; b se refiere a zonas afectadas por la enfermedad; Exp. se refiere a animales de experimentación. |
|||||
Tabla 1. Rendimiento diagnóstico del ELISA basado en el antígeno (Ssλ20∆B3) del ácaro Sarcoptes scabiei para el diagnóstico de la sarna sarcóptica en distintas especies domésticas y silvestres.
Este ELISA constituye una herramienta diagnóstica que nos permite realizar la vigilancia epidemiológica de la enfermedad en distintas poblaciones. El rebeco cantábrico comparte su hábitat con otros ungulados silvestres y domésticos, y puede, por lo tanto, tener relevancia en la epidemiología de agentes patógenos compartidos. Por ejemplo, en Asturias desde el comienzo de la epizootia en rebeco en 1993 y 2008 se registraron 80 ciervos con sarna. Por ello, se realizó un estudio serológico que combinado con datos de campo y de necropsias permitió concluir que la sarna sarcóptica no era una enfermedad emergente en el ciervo en la región (Oleaga y col, 2008b). En un estudio posterior realizado con muestras de 236 rebecos recogidas entre 2005-2008, se investigó si la cabra doméstica representaba una amenaza para el estado sanitario del rebeco cantábrico (Falconi y col, 2010). Se detectó una seroprevalencia media del 11,9% en rebeco y del 12,8% en la cabra y se comprobó que en Asturias había zonas con una prevalencia elevada de sarna en cabras (Figura 4). Se concluyó que la monitorización y detección temprana de cabras infectadas en zonas donde la población de rebecos no ha estado nunca en contacto con el ácaro puede ser crucial para el control de la enfermedad en esta especie.
Este ELISA también ha sido utilizado para estudiar la sarna sarcóptica en cánidos silvestres del Principado de Asturias (Oleaga y col., 2011, 2015). En lobo ibérico (Canis lupus) se analizaron sueros de 88 animales y se detectó una seroprevalencia del 20%. Estos resultados junto con los datos de necropsias (alopecia), el efecto limitado del ácaro en la condición corporal y las conclusiones de un estudio de fototrampeo mostraron una situación aparentemente estable de la enfermedad en Asturias. En el zorro (Vulpes vulpes) la sarna es endémica.
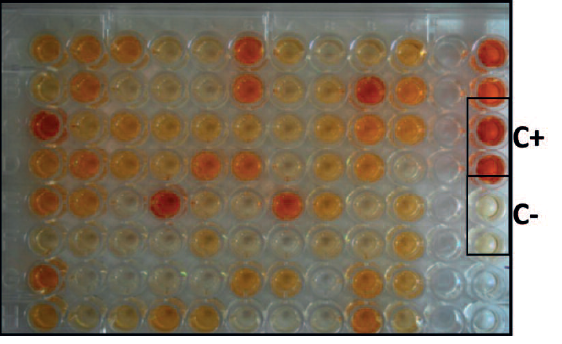
En el año 2010 se describió, por primera vez, un brote de sarna sarcóptica en conejo silvestre europeo en Mallorca. Este hallazgo generó preocupación en conservacionistas y gestores de caza, dado que un brote de sarna tras una translocación tendría consecuencias catastróficas para poblaciones “ingenuas” en otras partes de España. Por esta razón, se realizó un estudio serológico retrospectivo de 966 muestras recogidas entre 1993 y 2010 en la Península Ibérica, para determinar las tasas de contacto de estos conejos con S. scabiei. Se detectó un 13% de animales positivos en un 60% de las áreas examinadas en 16 de las 17 provincias e islas estudiadas, detectándose positivos en todos los años analizados (Millán y col., 2012).
Vacunas
La sarna sarcóptica es una patología de gran relevancia que persiste en todo el mundo a pesar de la disponibilidad de acaricidas para controlarla (Warner and Wendlberger, 2000; Voyvoda y col., 2005; Kurdete y col., 2007). El desarrollo de una vacuna frente a la sarna se considera una alternativa factible al control químico de la enfermedad (Nisbet y Huntley, 2006). Los posibles beneficios del uso de vacunas para tratar las enfermedades producidas por ectoparásitos frente al uso de insecticidas y acaricidas son numerosos: no producen contaminación medioambiental ni residuos en comestibles, evitan la exposición a químicos tóxicos de los manipuladores de animales, no requieren periodos de abstinencia tras el tratamiento, el coste de producción es bajo y la administración fácil (Shryock, 2004). Sin embargo, y a pesar del esfuerzo puesto durante años en la investigación y desarrollo de posibles vacunas frente a ectoparásitos, solo se ha logrado comercializar tres vacunas frente al parásito Boophilus microplus (la garrapata del ganado en zonas tropicales) (Willadsen y col, 1995). El desarrollo de vacunas frente a ectoparásitos se ha enfocado principalmente en dos tipos de candidatos o antígenos: los expuestos que se secretan en la saliva durante la alimentación del parásito y los ocultos que normalmente se expresan en su intestino y pueden estar involucrados en la digestión (McNair y col., 2010).
Se conoce poco sobre la inmunidad adquirida en hospedadores infectados con S. scabiei. Cabrera y col. (1993) demostraron que los antígenos de S. scabiei inducen en humanos la producción de anticuerpos específicos (respuesta inmune humoral) y una respuesta inmune celular. Sin embargo, no se sabe si esa respuesta inmune es capaz de eliminar o prevenir la multiplicación de los ácaros en la piel. Mellanby (1994) demostró que los humanos expuestos al ácaro desarrollaban una memoria inmunológica capaz de inducir resistencia a la reinfección. En cerdos se ha visto que la infección da lugar a la producción de anticuerpos específicos (Bornstein y Walgren, 1997). Por su parte, Tarigan (2003 a, b) demostró que cabras infectadas y posteriormente expuestas a sarcoptes eran resistentes a la reinfección, observándose en esos animales reacciones inflamatorias en la piel y la producción de niveles altos de anticuerpos (IgGs e IgEs) en suero frente a antígenos de sarcoptes. Un estudio más reciente concluyó que la respuesta inmune inflamatoria Th2 (T helper cell type 2) y las IgEs juegan un papel importante en la inmunidad adquirida en este hospedador (Tarigan y Huntley, 2005).
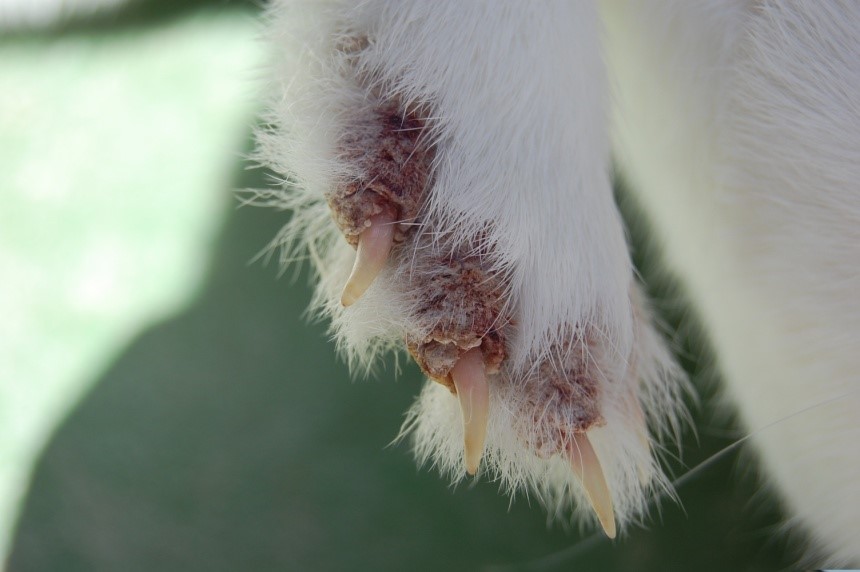
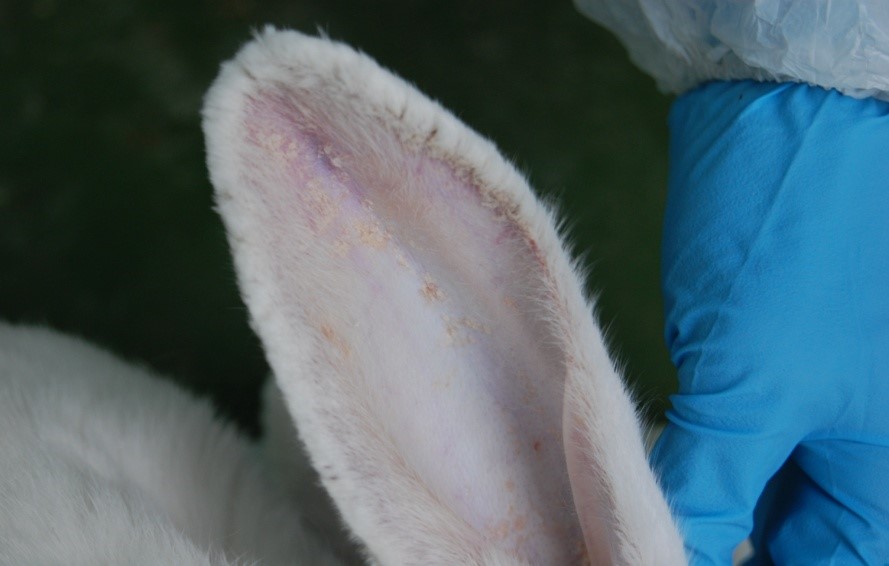
En el SERIDA se puso a punto un modelo animal de la enfermedad en conejo y hemos realizado infecciones experimentales de conejos de la raza New Zealand White utilizando ácaros de S. scabiei var. cuniculi procedentes de conejos silvestres de Mallorca infectados de forma natural (Figura 5). Este modelo se utilizó para estudiar: 1) los mecanismos de respuesta inmune (humoral y celular) y la patogenia de la enfermedad; 2) la adquisición de resistencia mediada por el sistema inmune tras una primera exposición al ácaro (Casais y col., 2014); y 3) el potencial vacunal de distintos combinados antigénicos preparados en nuestro laboratorio (Casais y col., 2016). Estos estudios indican que la vacunación de conejos con una combinación de antígenos inmunodominantes de sarcoptes induce niveles altos de IgGs (respuesta inmune humoral) y de citoquinas pro-inflamatorias, sin embargo, confiere una protección limitada frente a la infección.
Conclusión
El desarrollo de nuevos métodos de diagnóstico y vacunas eficaces permite establecer programas de vigilancia que aportan datos fundamentales para la gestión y control de las especies afectadas por este parásito, evitando la propagación de la enfermedad y la transmisión a los humanos, mejorando la rentabilidad de las explotaciones y optimizando el seguimiento de las epidemias de sarna en los animales silvestres.
Agradecimientos
Me gustaría expresar mi agradecimiento a todos los operarios, técnicos e investigadores que han participado en todos los trabajos revisados en este artículo.
Bibliografía
ARLIAN, L. G.; RAPP, C. M; MORGAN, M. S. (1995). Resistance and immune response in scabies-infested hosts immunized with Dermatophagoides mites. Am. J.Trop. Med. Hyg. 52(6):539-545.
ARLIAN, L. G., MORGAN, M. S, ARENDS, J.J. (1996). Immunologic cross-reactivity among various strains of Sarcoptes scabiei. J Parasitol. 82:66-72.
BORNSTEIN, S.; WALLGREN P. (1997). Serodiagnosis of sarcoptic mange in pigs. Vet. Rec. 141:8-12.
CABRERA, R.; ARAR, A.; DAHL, M. V. (1993). The immunology of scabies. Sem Dermatol. 12:15-21.CASAIS,
R.; PRIETO, M.; BALSEIRO, A.; SOLANO, P.; PARRA, F.; MARTÍN ALONSO J. M. (2007). Identification and heterologous expresión of a Sarcoptes scabiei cDNA encoding a structural antigen with immunodiagnostic potencial. Vet. Res. 38:435-450.
CASAIS, R.; GOYENA, E.; MARTÍNEZ-CARRASCO, C.; RUIZ DE YBÁÑEZ, R.; ALONSO DE VEGA, F.; RAMIS, G.; PRIETO, J. M.; BERRIATUA, E. (2013). Variable performance of a human derived Sarcoptes scabiei recombinant antigen ELISA in swine mange diagnosis. Vet Parasitol. 197(1-2), 397-403.
CASAIS, R.; DALTON, K. P.; MILLÁN, J.; BALSEIRO, A.; OLEAGA, A.; SOLANO, P.; GOYACHE, F.; PRIETO, J. M.; PARRA, F. (2014). Primary and secondary experimental infestation of rabbits (Oryctolagus cuniculus) with Sarcoptes scabiei from a wild rabbit: factors determining resistance to reinfestation. Vet. Parasitol. 203(1-2): 173-183.
CASAIS, R.; MILLÁN, J.; ROSELL, J. M.; DALTON, K. P.; PRIETO, J. M. (2015). Evaluation of an ELISA using recombinant antigen for the serological diagnosis of Sarcoptes scabiei infestation in domestic and wild rabbits. Vet Parasitol. 214(3-4), 315-321.
CASAIS, R.; GRANDA, V.; BALSEIRO, A.; DEL CERRO, A.; DALTON K. P.; GONZÁLEZ, R.; BRAVO, P.; PRIETO, J. M. and MONTOYA, M. (2016). Vaccination of rabbits with immunodominant antigens from Sarcoptes scabiei induced high levels of humoral responses and proinflammatory cytokines but confers limited
protection. Parasites & Vectors. 9, 435.
CARGILL, C. F.; POINTON, A. M.; DAVIES, P. R. and GARCÍA, R. (1997). Using slaughter inspections to evaluate sarcoptic mange infestation of finishing swine. Vet Parasitol. 70:191-200.
CURTIS, C. F. (2001). Evaluation of a commercially available enzyme-linked immunosorbent assay for the diagnosis of canine sarcoptic mange. Vet Rec. 148(8):238-9.
ELGART, M. L. (1990). Scabies. Dermatol. Clin. 8: 253-263.
FALCONI, C.; OLEAGA, A.; LÓPEZ-OLVERA, J.; CASAIS, R.; PRIETO, M.; GORTÁZAR, C. (2010). Prevalence of antibodies against selected agents shared between Cantabrian chamois (Rupicapra rupicapra parva) and domestic goats. Eur. J. Wild Res. 56:319-325.
FERNÁNDEZ-MORÁN, J.; GÓMEZ, S.; BALLESTEROS, F.; QUIRÓS, P.; BENITO, J. L.; FELIU, C.; NIETO, J. M. (1997). Epizootiology of sarcoptic mange in a population of Cantabrian chamois (Rupicapra pyrenaica parva) in Northwest Spain. Vet. Parasitol. 73: 163-171.
GONZÁLEZ-QUIRÓS, P.; SILVA MARZANO, P. y SOLANO RODRÍGUEZ, S. (2002a). Demographic patterns during an epizootic of sarcoptic mange in a Cantabrian chamois (Rupicapra pyrenaica parva) population. Pirineos 157:191-200.
GONZÁLEZ-QUIRÓS, P.; SILVA MARZANO, P. y SOLANO RODRÍGUEZ, S. (2002b). Population evolution of cantabrian chamois (Rupicapra pirenaica parva) with sarcoptic mange (Sarcoptes scabiei) in centre-eastern Asturias (Northwest Spain). Pirineos 157:201-209.
GONZÁLEZ-CANDELA, M.; LEÓN-VIZCAÍNO, L.; CUBERO- PABLO, M. J. .J. (2004). Population effects of sarcoptic mange in Barbary sheep (Ammotragus lervia) from Sierra Espuña Regional Park, Spain. Wildl Dis. 40(3):456-465.
HAMURAL, P.; MORGAN, M.; WALTON, S. F.; HOLT, D C.; RODE, J.; ARLIAN, L. G.; CURRIE, B. J. and
KEMP, D. J. (2003). Identification of a homologue of a house dust mite allergen in a cDNA library from Sarcoptes scabiei var. hominis and evaluation of its vaccine potential in a rabbit/S. scabiei var. canis model. Am J Trop Med Hyg. 68: 54-60.
KESSLER, E.; MATTHES, H. F.; SCHEIN, E.; WENDT, M. (2003). Detection of antibodies in sera of weaned pigs after contact infection with Sarcoptes scabiei var. suis and after treatment with an antiparasitic agent by three different indirect ELISAs. Vet Parasitol. 114(1):63-73.
KURTDEDE, A.; KARAER, Z.; ACAR, A.; GUZEL, M.; CINGI, C. C.; URAL, K.; ICA, A. (2007). Use of selamectin for the treatment of psoroptic and sarcoptic mite infestation in rabbits. Vet. Dermatol. 18(1): 18-22.
LAVIN, S.; VIÑAS, L.; MARCO, I. y RUIZ, M. (1998). Informe: Estudio experimental de la sarna en el rebeco (Rupicapra pyrenaica). Servicio de ecopatología de fauna silvestre de la Universidad Autónoma de Barcelona.
LAVÍN, S.; RUIZ-BASCARÁN, M.; MARCO, I.; FONDEVILLA, D. and RAMIS, T. (2000). Experimental infection of chamois (Rupicapra pirenaica parva) with Sarcoptes scabiei derived from naturally infected goats. J.Vet. Med. B. 47:693-639.
LEÓN-VIZCAÍNO, L.; RUIZ DE YBAÑEZ, M. R.; CUBERO, M. J.; ORTIZ, J. M.; ESPINOSA, J.; PÉREZ, L.; SIMÓN, M. A. (1999). Sarcoptic mange in Spanish ibex from Spain. Journal of Wildlife Diseases, 35:647-659.
LOWER, K. S.; MEDLEAU, L. M.; HNILICA, K.; BIGLER, B. (2001). Evaluation of an enzymelinked
immunosorbent assay (ELISA) for the serological diagnosis of sarcoptic mange in dogs. Vet Dermatol. 12(6):315-20.
MATTHES, H. F.; NOCKLER, K. and HIEPE, T. (1990). Klinischer Verlauf spontaner und experimenteller
Sarcoptes suis-Infektionen beim Schwein. Mh. Ve.-Med. 45:706-709.
MCNAIR, C. M.; BILLINGSLEY, P. F.; NISBET, A. J.; KNOX, D. P. (2010). Feeding-associated gen expression in sheep scab mites (Psoroptes ovis). Vet. Res. 41:16-23.
MELLANBY, K. (1944). The development of symptoms, parasitic infection and immunity in human scabies. Parasitology 35:197-206
MILLÁN, J.; CASAIS, R.; DELIBES-MATEOS, M.; CALVETE, C.; ROUCO, C.; CASTRO, F.; COLOMAR, V.; CASAS- DÍAZA, E.; RAMÍREZ, E.; MORENO, S.; PRIETO, J. M.; VILLAFUERTE, R. (2012). Widespread exposure to Sarcoptes scabiei in wild european rabbits (Oryctolagus cuniculus) in Spain. Vet. Parasitol. 183(3-4): 323-329.
NISBET, A. J.; HUNTLEY, J. F. (2006). Progress and opportunities in the development of vaccines against mites, fleas and myiasiscausing flies of veterinary importance. Par. Immunol. 28:165-172.
OLEAGA, A.; BALSEIRO, A.; GORTÁZAR, C. (2008a). Sarcoptic mange in two roe deer (Capreolus capreolus) from northern Spain. Eur J Wildl Res 54:134–137
OLEAGA, A.; CASAIS, R.; GONZÁLEZ-QUIRÓS, P.; PRIETO, M.; GORTÁZAR, C. (2008b). Sarcoptic mange in red deer from Spain: improved surveillance or disease emergence? Vet. Parasitol. 154: 103-113.
OLEAGA, A.; CASAIS, R.; BALSEIRO, A.; ESPÍ, A.; LLANEZ, L.; HARTASÁNCHEZ, A.; GORTÁZAR, C. (2011). “New techniques for an old disease: sarcoptic mange in the iberian wolf”. Vet Parasitol. 181(2-4): 255-266.
OLEAGA, A.; CASAIS, R.; PRIETO, J. M.; GORTÁZAR, C.; BALSEIRO, A. (2012). Comparative pathological and immunohistochemical features of Sarcoptic mange in five sympatric wildlife species in northern Spain. European Journal of Wildlife Research. 58(6), 997- 1000.
OLEAGA, A., VICENTE, J., FERROGLIO, E., PEGORARO DE MACEDO, M.R., CASAIS, R., DEL CERRO, A., ESP, A., García, E.J., Gortázar, C. (2015). Concomitance and interactions of pathogens in the Iberian wolf (Canis lupus). Res Vet Sci. 101: 22-27.
PENCE, D. and UECKERMANN, E. (2002). Sarcoptic mange in wildlife. Rev Sci Tech. 21:385-398.
RÁEZ-BRAVO, A., GRANADOS, J.E., SERRANO, E., DELLAMARIA, D., CASAIS, R., ROSSI, L., PUIGDEMONT, A., CANO-MANUEL, F.J., FANDOS, P., PÉREZ, J.M., ESPINOSA, J., SORIGUER R.C., CITERIO, C., LÓPEZ OLVERA, R. (2016). Evaluation of three enzyme-linked immunosorbent assays for sarcoptic mange diagnosis and assessment in the Iberian ibex, Capra pirenaica. Parasites & Vectors (2016) 9:558.
RAMBOZZI, L.; MENZANO, A.; LAVIN, S.; ROSSI, L. (2004). Biotin-avidin amplified ELISA for detection of antibodies to Sarcoptes scabiei in chamois (Rupicapra spp.). Vet Res. 35(6):701-8.
REHBEIN, S.; VISSER, M.; WINTER, R.; TROMMER, B.; MATTHES, H. F.; MACIEL, A. E.; MARLEY, S. E. (2003). Productivity effects of bovine mange and control with ivermectin. Vet
Parasitol. 114:267-284.
SHRYOCK, T. R. (2004). The future of anti-infective products in animal health. Nat. Rev. Microbiol.
2:425-430.
SKERRATT, L. F. (2003). Clinical response of captive common wombats (Wombatus urisnus) infected with Sarcoptes scabiei var. wombati. J. Wildl. Dis. 39:179-192.
TARIGAN, S. (2003a). Dermotopathology of caprine scabies and protective immunity in sensitised goats against Sarcoptes scabiei infestation. Jurnal Ilmu Ternak dan Veteriner 7:265-271.
TARIGAN, S. (2003b). Histopathological changes in naive and sensitised goats caused by Sarcoptes scabiei. Jurnal Ilmu Ternak dan Veteriner 8:114-121.
TARIGAN, S.; HUNTLEY, J. F. (2005). Failure to protect goats following vaccination with soluble proteins of Sarcoptes scabiei: Evidence for a role for IgE antibody in protection. Vet. Parasitol. 133:101-109.
VAN DER HEIJDEN, H. M.; RAMBAGS, P. G.; ELBERS, A. R.; VAN MAANEN, C.; HUNNEMAN, W. A. (2000). Validation of ELISAs for the detection of antibodies to Sarcoptes scabiei in pigs. Vet Parasitol. 89(1-2):95-107.
VOYVODA, H.; ULUTAS, B.; EREN, H.; KARAGENC, T.;BAYRAMLI, G. (2005). Use of doramectin for treatment of sarcoptic mange in five Angora rabbits. Vet. Dermatol 16:285-288.
WARNER, R.; WENDLBERGER, U. (2000). Field efficacy of moxidectin in dogs and rabbits naturally infested with Sarcopts spp., Demodex spp. and Psoroptes spp. Mites. Vet. Parasitol. 93(2):149-158.
WHO (World Health Organisation), 2001. http:www.who.int/water_sanitation_health/diseases/scabies/en/
WILLADSEN, P.; BIRD, P.; COBON, G. S.; HUNGERFORD, J. (1995). Commercialisation of a recombinant vaccine against Boophilus microplus. Parasitology. 110:S43-S50.
ZAHLER, M.; ESSIG, A.; GOTHE, R.; RINDER, H. (1999). Molecular analyses suggest monospecificity of the genus Sarcoptes (Acari: Sarcoptidae). Int. J. Parasitol. 29: 759-766.
ZIMMERMANN, W.; KIRCHER, P. (1998). Continuous serologic study and sanitation inspection of Sarcoptes scabiei var. suis infection: preliminary results. Schweiz Arch Tierheilkd. 140(12):513-7 .
| Ficha Bibliográfica | |
|---|---|
| Título | La sarna sarcóptica en especies domésticas y silvestres del Principado de Asturias. Diagnóstico y vacunas |
| Autor/es | ROSA CASÁIS GOYOS. Área de Sanidad Animal. Centro de Biotecnología Animal de Deva. rosacg@serida.org |
| Año Publicación | 2022 |
| Área | |
| Revista/Serie | Tecnología Agroalimentaria. Boletin del SERIDA. |
| Referencia | Nº27. Pags 30-38. |
| Formato | |
| Depósito Legal | 2.617/1995 |
| ISSN | 1135-6030 |
| ISBN | |
| Ver/Descargar | |

