Publicaciones SERIDA
Bacterias asociadas al decaimiento del roble en Asturias
ANA J. GONZÁLEZ. Área de Cultivos Hortofrutícolas y Forestales. Programa de Patología Vegetal. anagf@serida.org
MARTA CIORDIA ARA. Área de Cultivos Hortofrutícolas y Forestales. Programa Forestal. mciordia@serida.org
Se ha identificado en Asturias la presencia de las bacterias Brenneria goodwinii y Gibbsiella quercinecans en roble (Quercus robur L.), que han sido asociadas, entre otros factores, al decaimiento de esta frondosa.
¿Qué es el Decaimiento del Roble?
Es una enfermedad que afecta a diversas especies de árboles del género Quercus spp.
La regresión y decaimiento de roble común (Q. robur L.) y de roble albar [Q. petraea (Matt.), Liebl.] ya se referenciaba desde finales del siglo pasado en el Reino Unido y la Europa continental. Según sea el efecto de la enfermedad en el árbol (Bakhshi Ganje et al 2019), se han descrito dos tipos de Decaimiento del Roble:
- si es lento, se denomina Decaimiento Crónico del Roble, conocido por sus siglas en inglés COD (Chronic Oak Decline) y,
- si es rápido, Decaimiento Agudo del Roble, o AOD por sus siglas en inglés (Acute Oak Decline).
AOD se diagnosticó por primera vez en Reino Unido a finales de los años 80 y actualmente esta enfermedad emergente tiene una alta y grave incidencia en los robles de Reino Unido. Se han descrito brotes de esta enfermedad en otros países, como Irán, o incluso España, donde se han observado diferentes grados de decaimiento en robles en Galicia y Asturias.
Síntomas externos del Decaimiento del Roble
Los robles afectados muestran decaimiento, defoliación, ramas puntisecas y, lesiones ovales y grietas verticales exclusivamente en la corteza del árbol. Resultan llamativos los exudados de color oscuro. Generalmente, pueden observarse también galerías de larvas con agujeros de salida en forma de “D” de escarabajos adultos de Agrilus biguttatus (Barrenador de roble de dos puntos).
¿A qué especies de roble afecta?
La enfermedad ataca, principalmente, a los árboles del roble común o roble carbayo (Q. robur) y, en menor medida, a los de roble albar (Q. petraea). AOD, o síntomas similares, también se ha descrito en otras especies del género Quercus (Q. ilex, Q. pirenaica, Q. cerris, Q. castaneifolia y Q. macranthera).
¿Qué organismos están implicados?
Esta enfermedad parece estar asociada a una combinación de factores abióticos y bióticos, incluyendo la sequía como consecuencia del impacto del cambio climático. Entre los agentes bióticos se incluye un complejo polimicrobiano, en el que están presentes principalmente dos bacterias patógenas Brenneria goodwinii y Gibbsiella quercinecans, además de Rahnella o Lonsdalea; así como hongos y oomicetos, como por ejemplo, Phytophthora, Daldinia o Biscogniauxia. Algunos insectos, como el escarabajo Agrilus biguttatus, plaga que causa importantes daños a los robles y muy asociada a AOD en Reino Unido, también están implicados (Denman et al, 2012, 2014, 2016).
Situación en Asturias
En junio de 2017 se observaron daños en un roble común, o carbayo, (Q. robur) del concejo de Vegadeo que consistían en un chancro con grietas en la corteza y producción de un exudado oscuro (Figura 1).
Figura 1. Carbayo sintomático con exudados
Los síntomas eran coincidentes con infección bacteriana, por lo que se analizó la muestra para determinar la etiología.
Se aislaron dos especies de enterobacterias muy próximas entre sí, ya que en las pruebas bioquímicas realizadas resultaron ser ambas gram negativas, y fermentativas, positivas en las pruebas de beta-galactosidasa, manitol, sorbitol, inositol, ramnosa, sacarosa, melibiosa, amigdalina y arabinosa; y negativas para citocromo-c-oxidasa, arginina dehidrolasa, ornitina decarboxilasa, producción de H2S, ureasa, triptófano deaminasa, indol y gelatinasa. Sólo se diferenciaron en la prueba del citrato, siendo una positiva (LPPA-3461) y otra negativa (LPPA-3463).
Para su correcta identificación se acudió a técnicas moleculares, secuenciando el ADN ribosomal 16S que se comparó con las secuencias depositadas en bases de datos (GenBank). Así, se vió que la cepa LPPA-3461 tenía similitud con Gibbsiella quercinecans Brady et al, y LPPA-3463 con Brenneria goodwinii Denman et al. Estas bacterias, como se ha indicado previamente, se han asociado por parte de investigadores británicos con el Decaimiento Agudo del Roble.
Dado que Brady et al (2016) consideran que para identificar con precisión las bacterias es necesario obtener también las secuencias del gen gyrB (ADN girasa subunidad B), amplificamos este gen y, además, el gen atpD (ATP sintasa), incorporando ambos genes al estudio molecular. Estas secuencias corroboraron el mismo resultado que el obtenido con el ADN 16S.
Para estudiar la relación de parentesco entre las bacterias diagnosticadas se realizó un árbol filogenético con los tres genes concatenados, ADN 16S, gyrB y atpD. Se utilizaron los métodos Neighbor-Joining (Saitou and Nei 1987) con el modelo Kimura-2 (Kimura 1980) y Maximum-Likelihood basado en el modelo Tamura-Nei (Tamura and Nei 1993), ambos con un “bootstrap” of 1.000 réplicas, mediante Mega 7 software (Kumar et al 2016). El resultado se puede ver en la Figura 2. Conviene aclarar que un “bootstrap” es un método estadístico que se centra en el remuestreo de datos dentro de una muestra aleatoria o al azar, para buscar una aproximación a la distribución de la variable analizada.
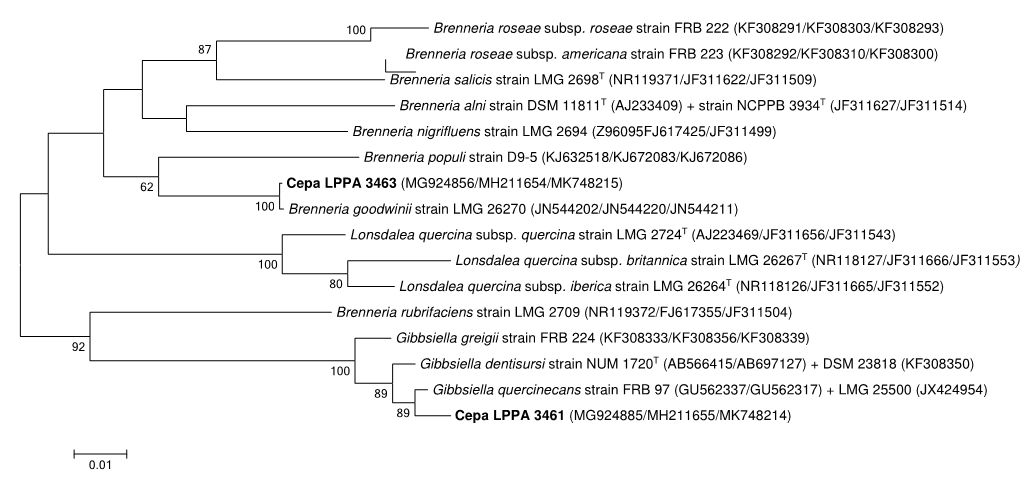
Figura 2. Árbol filogenético realizado mediante el método “Maximum Likelihood” con las secuencias concatenadas de los genes 16S DNAr, gyrB y atpD, en el que se puede ver cómo las cepas LPPA 3461 y LPPA 3463 agrupan con G. quercinecans and B. goodwinii, respectivamente. Las distancias evolutivas se calcularon usando el modelo de Tamura-Nei. Se indican en las ramas los valores de “bootstrap” >50% (sobre 1.000 réplicas). El análisis incluyó 16 secuencias nucleotídicas, con un total de 2.487 posiciones por secuencia.
Para comprobar la patogenicidad de estas dos especies bacterianas en el carbayo, se realizaron inoculaciones de las mismas en bellotas (Biosca et al. 2003), mediante inyección de una suspensión bacteriana de aproximadamente 108 ufc/ml (ufc, unidades formadoras de colonia). Como control se utilizaron bellotas inyectadas con agua estéril. Las bellotas se incubaron a 28ºC en cámara húmeda durante 15 días y el ensayo se repitió dos veces.
Al cabo de estos 15 días, se comprobó que el 80% de las bellotas inoculadas con G. quercinecans y el 90% de las inoculadas con B. goodwinii, presentaban podredumbres, mientras que el control sólo mostraba la marca del pinchazo (Figura 3).
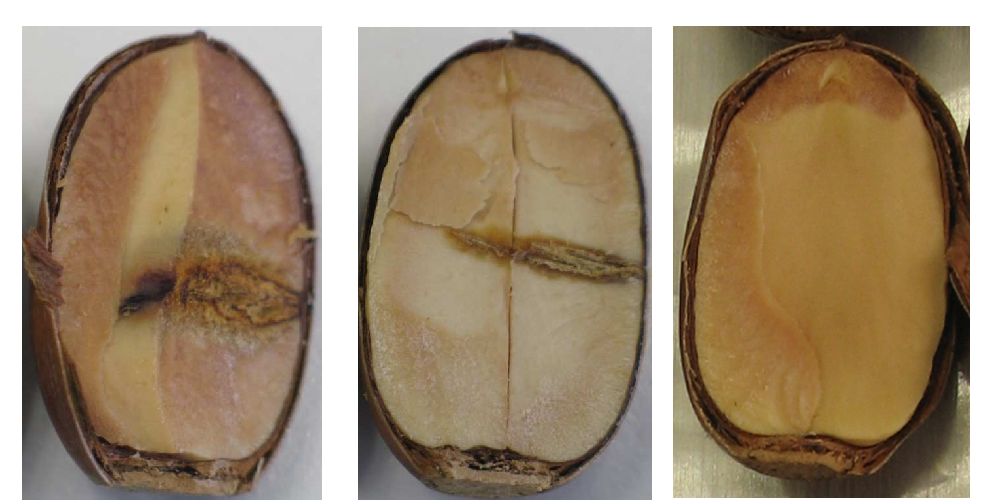
Figura 3. Bellotas inoculadas, a la izquierda con B. goodwinii, en el centro con G. quercinecans y a la derecha, con agua estéril.
La presencia de galerías del bupréstido Agrilus biguttatus no se ha observado en el árbol sintomático analizado, si bien este insecto está presente en Asturias (Arnáiz 1999).
G. quercinecans ya había sido descrita en España en Quercus ilex L. y en Q. pyrenaica Willd. (Brady et al 2010), mientras que B. goodwinii no se había encontrado en nuestro país. Por lo tanto, ésta es la primera referencia de la presencia de B. goodwinii y G. quercinecans en Q. robur en España.
Referencias
Arnáiz L. (1999). Los Bupréstidos del cuadrante noroccidental español (Coleoptera, Buprestidae). Graellsia, 55: 163-176.
Bakhshi Ganje M, Shams-Bakhsh M, Mackay John, Rahimian H. (2019). Identification and characterization of bacterial strains associated with diseased oak trees in Northern Iran. Forest Pathology. 50 (4):e12571.
Biosca EG, González R, López-López MJ, Soria S, Montón C, Pérez-Laorga E, López MM. (2003). Isolation and characterization of Brenneria quercina, causal agent for bark canker and drippy nut of Quercus spp. in Spain. Phytopathology. 93: 485-492.
Brady C, Denman S, Kirk S, Venter S, Rodríguez-Palenzuela P, Coutinho T. (2010). Description of Gibbsiella quercinecans gen. nov., sp. nov., associated with Acute Oak Decline. Syst. Appl. Microbiol. 33: 444-450.
Denman S, Brady C, Kirk S, Cleenwerck I, Venter S, Coutinho T, De Vos P. (2012). Brenneria goodwinii sp. nov., associated with acute oak decline in the UK. Int. J. Syst. Evol. Microbiol. 62: 2451-2456.
Denman S, Brown N, Kirk S, Jeger M, Webber J. (2014). A description of the symptoms of Acute Oak Decline in Britain and a comparative review on causes of similar disorders on oak in Europe. Forestry. 87: 535–551.
Denman S, Plummer S, Kirk S, Peace A, McDonald JE. (2016). Isolation studies reveal a shift in the cultivable microbiome of oak affected with Acute Oak Decline. Syst. Appl. Microbiol. 39 (7): 484-490.
Kimura M. (1980). A simple method for estimating evolutionary rate of base substitutions through comparative studies of nucleotide sequences. Journal of Molecular Evolution. 16: 111–120.
Kumar S, Stecher G, Tamura K (2016). MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Molecular Biology and Evolution. 33: 1870–1874.
Saitou N & Nei M. (1987). The neighbor-joining method: A new method for reconstructing phylogenetic trees. Molecular Biology and Evolution, 4:406-425
| Ficha Bibliográfica | |
|---|---|
| Título | Bacterias asociadas al decaimiento del roble en Asturias |
| Autor/es | ANA J. GONZÁLEZ. Área de Cultivos Hortofrutícolas y Forestales. Programa de Patología Vegetal. anagf@serida.org MARTA CIORDIA ARA. Área de Cultivos Hortofrutícolas y Forestales. Programa Forestal. mciordia@serida.org |
| Año Publicación | 2021 |
| Área | Cultivos Hortofrutícolas y Forestales. |
| Revista/Serie | Tecnología Agroalimentaria. Boletín informativo del SERIDA |
| Referencia | Nº 24: 18-21 |
| Formato | |
| Depósito Legal | AS 2617/1995 |
| ISSN | 1135-6030 |
| ISBN | |
| Ver/Descargar | |

